 货号:STM-CL-8159 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-8159 规格:1×10⁶cells/T25培养瓶或1mL冻存管
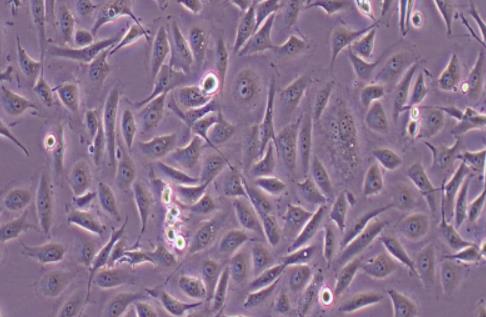
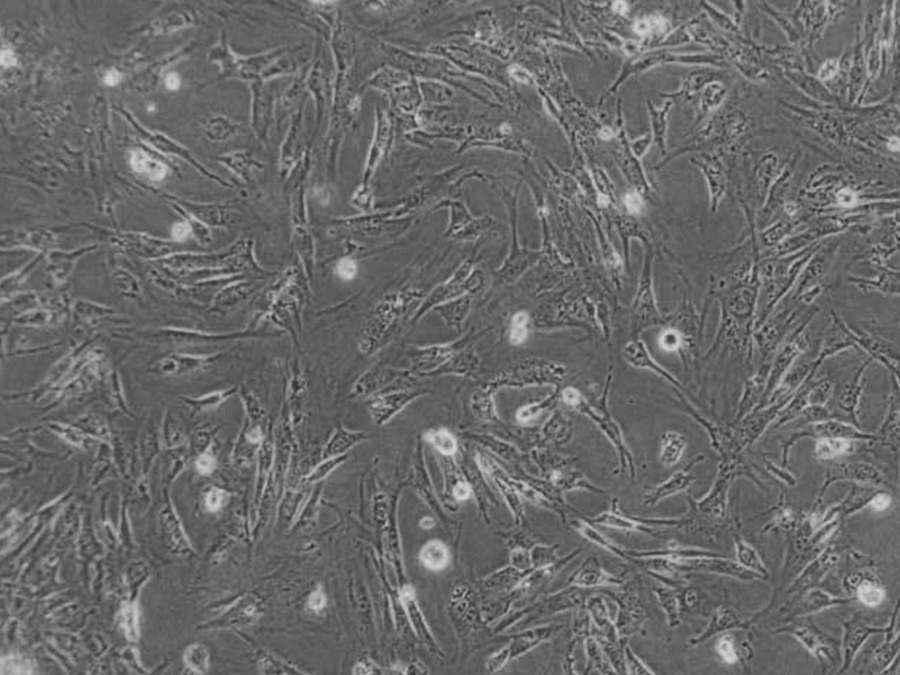
OK细胞系(负鼠肾细胞) 热销
- 来源:正常;肾,皮质;近小管
- 细胞特征:贴壁细胞 , 上皮细胞样
- 培养基:MEM(含NEAA)+10% FBS+1% P/S
- 其他:OK细胞在培养中多种表达吸收,包括α2起始素能吸收、心钠素(ANP)、血清素及甲状旁腺激素(PTH)吸收等
OK负鼠肾细胞(OK Opossum Kidney Cells)是一种从成年雌性北美负鼠(Didelphis virginiana)的近端小管上皮细胞中分离的细胞系。最初建立OK细胞的目的是提供用于研究X染色体失活的细胞来源,但随后发现其具备广泛的生物学应用,尤其在肾近端小管上皮细胞相关研究中表现出优良的培养特性和实验适用性。在培养条件下,OK细胞显示出多种重要受体的表达特征,是研究这些受体功能的理想模型。
OK细胞系特性特征
吸收表达:OK Cell在培养中展示出多种吸收表达:α2抵抗力、心钠素(ANP)受体、血清素受体、甲状旁腺激素(PTH)受体
酶缺乏:与其他肾小管细胞系相比,OK细胞缺乏一些特定的近端小管酶,这在某些研究中具有独特的优势。
基因表达:OK细胞能够表达与肾脏功能相关的多个基因,尤其是在研究肾脏多巴胺生理学方面表现突出。
X染色体研究:OK细胞系首次针对X染色体失活的研究,提供了一个理想的模型来探讨X染色体的功能和调控机制。
多巴胺能生理学:OK细胞增强产生和退化多巴胺的能力,被广泛用于研究肾脏多巴胺能生理学。
OK细胞系参数表
| 细胞名称 | OK细胞系(负鼠肾细胞)(Opossum Kidney Cells) |
| 细胞别称 | Opossum Kidney; OK-WT;Didelphis virginiana(北美负鼠) |
| 组织来源 | 肾,主要为近端小管上皮细胞 |
| 细胞形态 | 上皮样细胞,贴壁生长 |
| 细胞数量 | 每个冻存管中约含有100万细胞(1 x 10^6 cells/vial/T25) |
| 培养基 | MEM(含 NEAA)+10% FBS+1% P/S |
| 培养条件 | 温度:37°C;CO2浓度:5%;湿度:70%-80% |
| pH值 | 7.2 - 7.4 |
| 传代比例 | 1:4至1:6 |
| 细胞密度 | 达到80%-90%时进行 |
| 冻存成分 | 90%胎牛血清 + 10% DMSO |
| 无菌检测 | 细菌、酵母、支原体阴性 |
| 病原检查 | HIV、HBV、HCV均为阳性 |
| 代数范围 | 2-4代 |
| 用途限制 | 科研科研使用,可用于临床诊断和治疗 |
| 生长特性 | 迅速发展,预见强,转染效率高 |
| 特性 | α2引入素能吸收、心钠素(ANP)、血清素、甲状旁腺激素(PTH)吸收等 |
培养教程
OK负鼠肾细胞系培养教程
OK细胞复苏
将冻存管中的OK细胞迅速置于37°C水浴中,轻轻摇晃以加速解冻,直至完全融化。
解冻后,立即将OK细胞悬液加入4 -9mL预先准备好的培养基中,以去除冷冻保护剂并轻轻混匀。
在1000 RPM下离心4-5分钟,将OK细胞与冷冻保护剂分离,弃去上清液。
补加1-2 mL培养基重悬OK细胞,并轻轻吹匀,以确保OK细胞分散均匀。
将OK细胞悬液转移至培养瓶或10 cm培养皿中,并补充约8 mL培养基。
将培养皿置于培养箱中过夜培养,次日检查OK细胞的贴壁情况和生长状态。
OK细胞传代
当OK细胞密度达到80%-90%时,即可进行传代。
弃去培养基上清后,用不含钙、镁的PBS润洗OK细胞1-2次,以去除残留血清。
加入2 mL含0.25%胰蛋白酶和0.53 mM EDTA的消化液,在37°C培养箱中消化1-2分钟,观察OK细胞是否变圆并脱落。
消化完成后,加入少量培养基终止消化,轻敲培养瓶底以帮助OK细胞从瓶壁脱落。
将OK细胞用6-8 mL培养基重悬,并在1000 RPM下离心4分钟,弃去上清液。
根据实验需求,将OK细胞按1:2至1:5的比例分配到新的培养瓶或皿中,补加8 mL新鲜培养基,继续培养。
OK细胞冻存
选择生长状态良好的OK细胞进行冻存。弃去培养基后,用PBS清洗OK细胞1-2次。
加入1 mL胰蛋白酶,待OK细胞完全脱落后,补加2 mL完全培养基终止消化。
在1000 RPM下离心5分钟,去除上清液。
用含10% DMSO的胎牛血清作为冻存液,将OK细胞重悬于冻存液中,迅速混匀,以确保OK细胞均匀分布。
将OK细胞悬液分装至冻存管,每管1 mL,并做好标签标记。
将冻存管置于程序降温盒中,首先在-80°C下保存至少2小时,然后转入液氮罐中长期储存。
注意事项
收到OK细胞后,应检查细胞瓶是否完好无损,若发现漏液或浑浊现象,请及时与供应商联系。
传代时若OK细胞密度未达80%,应继续培养至合适密度再进行传代。
操作过程中始终保持无菌操作,防止OK细胞培养被污染。

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值