 货号:STM-CL-5008 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-5008 规格:1×10⁶cells/T25培养瓶或1mL冻存管
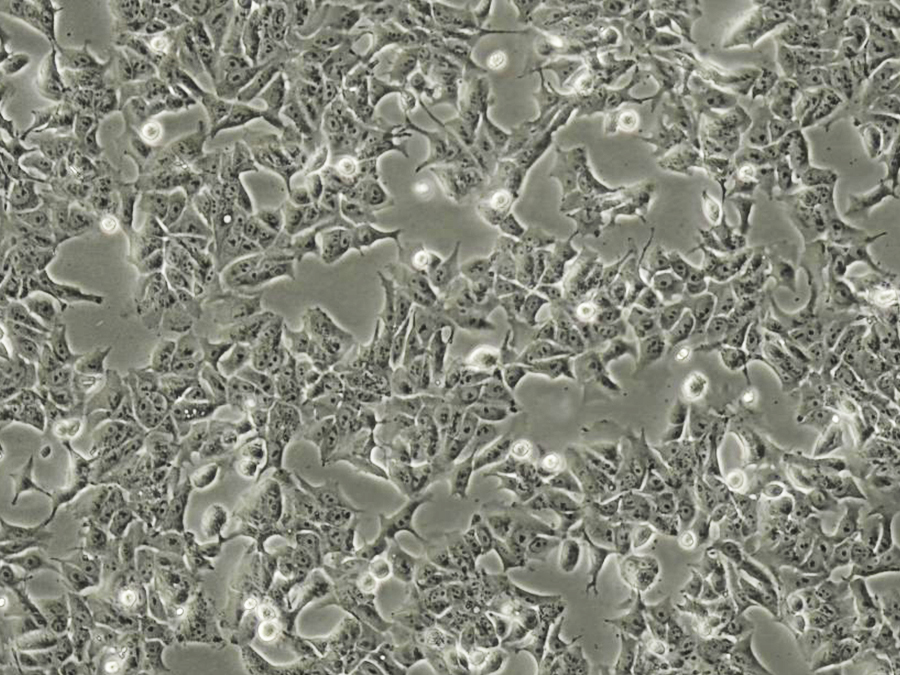
DLD-1细胞(人结直肠腺癌上皮细胞) 热销
- 来源:结直肠腺癌
- 细胞特征:贴壁细胞 , 上皮细胞样
- 培养基:RPMI-1640+10% FBS+1% P/S
- 其他:DLD-1细胞p53抗原阳性,具有C→T点突变,导致241位的Ser→Phe变化
DLD-1细胞源自结直肠腺癌的假二倍体人类细胞系,最初从一名结肠腺癌患者的大肠组织中分离获得,常用于癌症研究,特别是在转染实验中作为合适的宿主。
DLD-1细胞系具有46条染色体的模式核型,其中86%的细胞保持这一核型。多倍体细胞的比例约为17.1%。其核型特征包括46, XY, -2, +dir dup(2)(p13-p23),其中Y染色体相对于N22染色体稍长,并在远端q臂存在明显的异色荧光区。
DLD-1细胞是已被鉴定为来源于单个个体的四种结直肠腺癌细胞系之一。DNA图谱研究表明,DLD-1xb、HCT-15细胞、HCT-8细胞和HRT-18G细胞共享一个图谱。
DLD-1细胞特性特征
致瘤性:DLD-1细胞在裸小鼠中进行皮下接种(10^7个细胞),21天内100%(5/5)出现肿瘤,显示出良好的致瘤性。
癌基因表达:DLD-1细胞对多种癌基因呈阳性反应,myc+;myb+;ras+;fos+;sis+;abl-;ros;src-。p53抗原表达呈阳性,且其突变形式为C→T点突变,导致241位的Ser→Phe变化。
抗原表达:DLD-1细胞表达O型血抗原,对角蛋白和波形蛋白呈弱阳性反应,角蛋白免疫过氧化物酶染色结果为阳性。
基因表达:该细胞系中癌胚抗原(CEA)表达为0.5 ng/10^6个细胞/10天,结肠抗原3表达。
同工酶特征:DLD-1细胞的同工酶谱包括ES-D(1-2)、G6PD(B)、PEP-D(1)、PGD(A)、PGM1(1)和PGM3(1)。
细胞遗传学:DLD-1细胞与HCT-15细胞在DNA指纹鉴定和染色体组型分析中显示出相似性,表明它们可能源自同一患者的不同克隆。尽管遗传起源得到证实,但它们在染色体标记上并无一致性改变。
污染与处理:1979年DLD-1细胞曾被猪鼻支原体污染,经过12周的抗生素联合培养处理后,细胞检测结果在连续11个月的无抗生素培养中均为阴性
DLD-1人结直肠腺癌上皮细胞参数表
| 细胞名称 | DLD-1细胞(人结直肠腺癌上皮细胞) |
| 别称 | DLD 1; DLD1; CoCL3 |
| 种属来源 | 人 |
| 年龄性别 | 成年男性 |
| 组织来源 | 结直肠腺癌上皮细胞 |
| 生长特性 | 贴壁生长 |
| 细胞形态 | 上皮细胞样 |
| 致瘤性 | 在裸小鼠中接种10^7个细胞后21天100%出现肿瘤 |
| 癌基因表达 | c-myc+;myb+;K-ras+;H-ras+;N-ras+;fos+;sis+;p53+ |
| p53突变 | C→T点突变,导致241位的Ser→Phe变化 |
| 抗原表达 | O型血抗原,角蛋白和波形蛋白弱阳性 |
| 基因表达 | 癌胚抗原(CEA)0.5 ng/10^6细胞/10天 |
| 同工酶特征 | ES-D(1-2);G6PD(B);PEP-D(1);PGD(A);PGM1(1);PGM3(1) |
| 培养基 | RPMI-1640 + 10% 胎牛血清 + 1% 双抗 |
| 培养条件 | 37℃,CO2浓度5% |
| 传代比例 | 1:3至1:4 |
| 换液频率 | 2-3次/周 |
| 消化时间 | 2-3分钟 |
| 冻存条件 | 55%基础培养基、40%胎牛血清和5% DMSO |
| 污染处理 | 1979年曾被猪鼻支原体污染,经过12周抗生素处理后阴性 |
培养教程
DLD-1人结直肠腺癌上皮细胞培养教程
DLD1细胞复苏
将水浴锅预热至37℃,准备用于复苏DLD1细胞的完全培养基(RPMI-1640,补充10%胎牛血清和1%青霉素/链霉素)。
从液氮中取出冷冻的DLD1细胞管,迅速放入37℃的水浴中,轻轻摇动1-2分钟,直至DLD1细胞完全融化。
将融化后的DLD1细胞迅速转移至无菌的15 mL离心管中,并加入9 mL预热的完全培养基,轻轻混匀。
以1000 rpm离心5分钟,弃去上清液。
用1-2 mL的完全培养基重悬DLD1细胞,并将细胞悬液转移至T-25培养瓶中。
将培养瓶放入37℃、5% CO₂培养箱中孵育2-3小时,以使DLD1细胞恢复并贴壁。
DLD1细胞培养
培养基:RPMI-1640培养基,补充10%胎牛血清和1%青霉素/链霉素,用于DLD1细胞的培养。
培养条件:在37℃、5% CO₂、95%湿度的条件下培养DLD1细胞。
换液频率:每2-3天更换一次培养基,以确保DLD1细胞的培养环境清洁并支持其健康生长。
DLD1细胞观察:定期显微镜下观察DLD1细胞的形态和生长状态,确认DLD1细胞无污染,生长状况良好。
DLD1细胞传代
当DLD1细胞达到80-90%的融合度时,应进行传代,以避免DLD1细胞过度拥挤。
取出DLD1细胞培养瓶,弃去培养基,加入1-2 mL 0.25%胰酶溶液,覆盖DLD1细胞,置于37℃培养箱中消化2-3分钟,直至DLD1细胞变圆且开始脱落。
轻轻敲击培养瓶底部,确保所有DLD1细胞均已脱离瓶壁。
加入等体积的完全培养基中和胰酶,轻轻混匀DLD1细胞悬液。
以1000 rpm离心5分钟,弃去上清液。
将DLD1细胞用适量的完全培养基重悬。
按1:3至1:4的比例将DLD1细胞悬液分装至新的培养瓶中,添加适量的完全培养基。
将新培养瓶置于培养箱中,继续培养DLD1细胞。
DLD1细胞冻存
配制DLD1细胞的冻存液,成分为:55%完全培养基、40%胎牛血清和5%二甲基亚砜(DMSO)。
将DLD1细胞以1000 rpm离心5分钟,弃去上清液。
将DLD1细胞重悬在预先准备好的冻存液中,混匀。
将重悬好的DLD1细胞分装至冻存管中,并清晰标记DLD1细胞类型、传代次数及冻存日期。
将冻存管先置于-80℃冰箱中过夜,随后移入液氮罐中长期保存DLD1细胞。
注意事项
DLD1细胞的冻存和复苏过程应严格保持无菌操作,以避免细胞污染。
培养DLD1细胞的培养基使用前需新鲜配制,已用于细胞复苏或培养的培养基不应再次使用。
定期监测DLD1细胞状态,确保其无污染并生长良好。
相关资料
STR鉴定及相关
| Amelogenin | X,Y |
| CSF1PO | 11,12 (AddexBio=C0009007/36; ATCC=CCL-221; CCRID; DSMZ=ACC-278; ECACC=90102540; JCRB=JCRB9094; KCLB=10221; PubMed=25877200; PubMed=25926053) |
| 12 (CLS=300220; TKG=TKG 0379) | |
| D2S441 | 13,15 |
| D2S1338 | 17,25 |
| D3S1358 | 17 |
| D5S818 | 13 |
| D6S1043 | 11,13 |
| D7S820 | 10,12 |
| D8S1179 | 15 |
| D12S391 | 19,22 |
| D13S317 | 8,11 |
| D16S539 | 12,13 |
| D18S51 | 11,17 |
| D19S433 | 14,16 |
| D21S11 | 29,32.2 |
| FGA | 22 |
| Penta D | 9,14 |
| Penta E | 7,14 |
| TH01 | 7,9.3 |
| TPOX | 8,11 |
| vWA | 18,19 |

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值 
