 货号:STM-CL-5284 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-5284 规格:1×10⁶cells/T25培养瓶或1mL冻存管
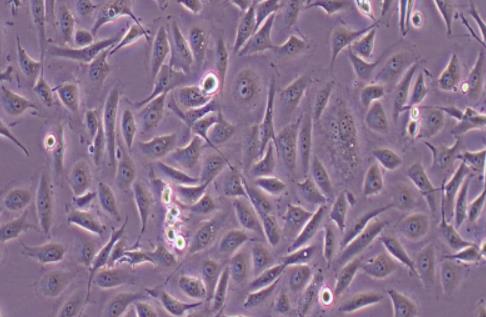
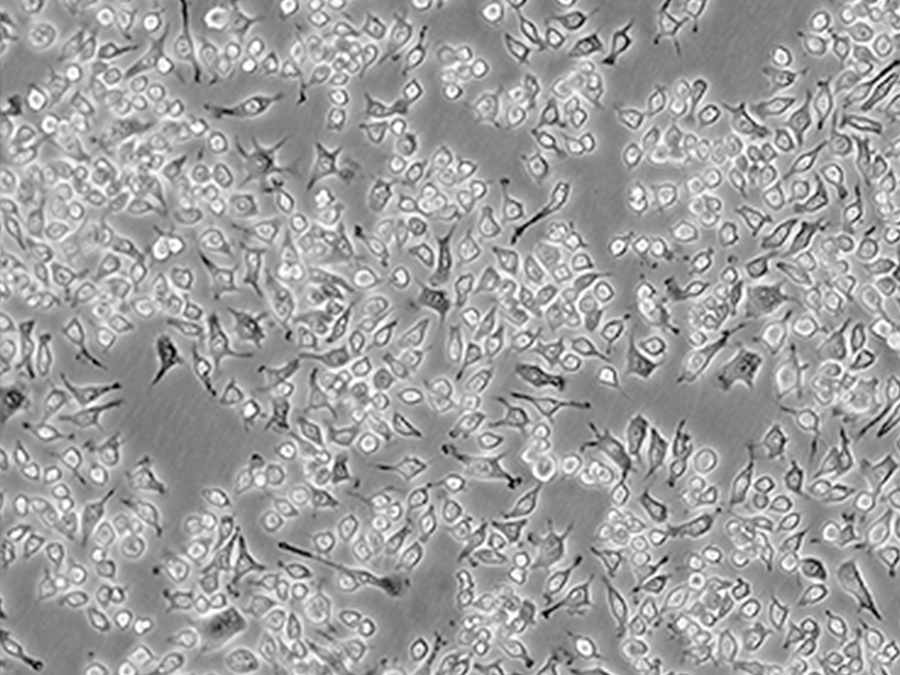
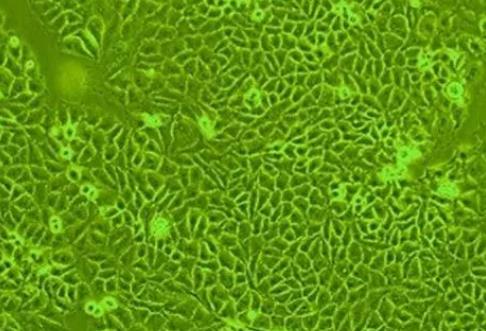
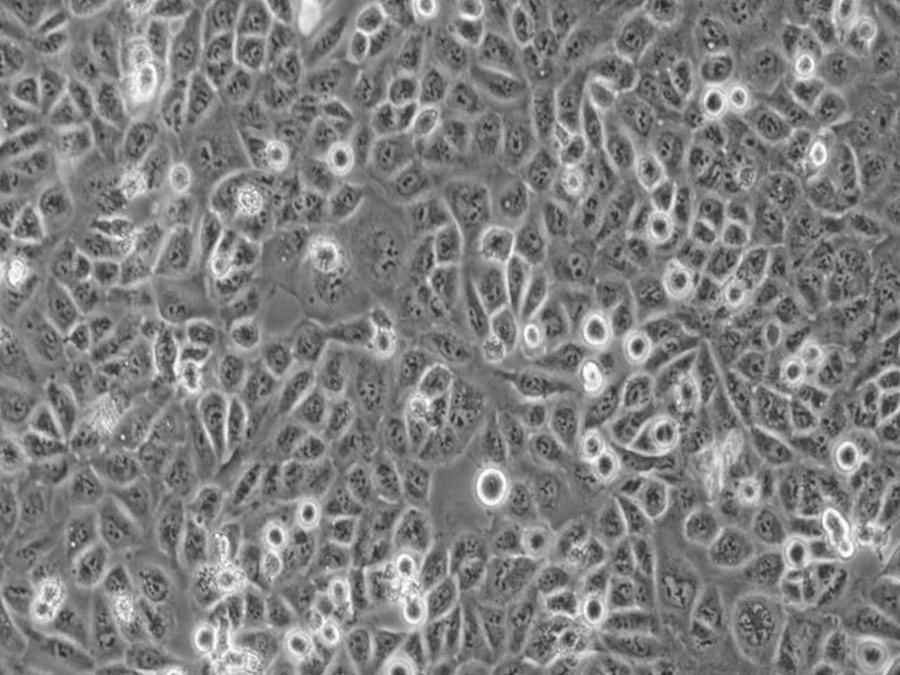
Nthy-ori 3-1细胞(人甲状腺正常细胞) 热销
- 来源:甲状腺
- 细胞特征:贴壁细胞 , 上皮细胞样
- 培养基:生长培养基:1640+10% FBS+1% P/S
- 其他:是用含有起源缺陷SV40基因组(SV-ori)的质粒转染正常人原代甲状腺滤泡上皮细胞,使其永生化
Nthy-ori 3-1 细胞系来源于人类甲状腺滤泡上皮细胞,是正常而非癌变的甲状腺细胞系。科学家将含有起源缺陷的 Simian virus 40 (SV40) 基因组(SV-ori)质粒转染至正常的人类甲状腺滤泡上皮细胞中实现永生化。SV40 DNA 的作用不仅能使这些细胞永生化,还能保留它们的多种功能。
Nthy-ori 3-1 细胞系有着广泛应用,包括转染实验和病毒学研究,还用于探索人类甲状腺的生长和调控机制,并在 microRNA(miRNA)表达谱分析中发挥重要作用。
Nthy-ori 3-1细胞特征特性
分子特征
表达甲状腺特异性蛋白:Nthy-ori 3-1细胞表达多种甲状腺特异性蛋白,包括甲状腺球蛋白(Thyroglobulin, TG)、甲状腺过氧化物酶(Thyroid peroxidase, TPO)和钠/碘共转运体(Sodium/iodide symporter, NIS)。
激素反应性:这些细胞对甲状腺刺激激素(TSH)具有反应性,可以模拟正常甲状腺细胞的激素调节机制。
表达特征
上皮细胞标志物:Nthy-ori 3-1细胞表达典型的上皮细胞标志物,如细胞角蛋白(Cytokeratin)。
甲状腺功能相关基因:这些细胞表达与甲状腺激素合成和分泌相关的基因,包括甲状腺球蛋白(TG)、甲状腺过氧化物酶(TPO)和钠/碘共转运体(NIS)基因。
基因特征
正常核型:Nthy-ori 3-1细胞保持正常的人类二倍体核型,没有明显的染色体异常。
无癌基因突变:这些细胞不携带常见的甲状腺癌相关基因突变,如BRAF V600E或RAS突变,这使它们成为研究甲状腺癌发生机制的理想对照。
其他特性
生长特性:Nthy-ori 3-1细胞呈贴壁生长,形态为上皮样。
稳定性:这些细胞在体外培养条件下保持相对稳定的表型和基因型特征。
可转染性:Nthy-ori 3-1细胞可以被用来构建稳定表达外源基因的细胞系,如荧光素酶表达细胞系(Nthy-ori 3-1-Luc),这为更复杂的实验设计提供了可能。
碘代谢:这些细胞保留了正常甲状腺细胞的碘摄取和代谢能力,可用于研究甲状腺激素合成过程
Nthy-ori 3-1细胞参数表
| 细胞名称 | Nthy-ori 3-1细胞(人甲状腺正常细胞) |
| 细胞别称 | Nthy ori 3.1;Nthy-ori 3.1;NTHY-ORI3.1;HTori-3.1;nythori31 |
| 细胞类型 | 人类甲状腺正常上皮细胞 |
| 细胞形态 | 贴壁生长,呈圆形、椭圆形或不规则形状; |
| 生长特性 | 形成单层或多层细胞群落 |
| 培养基 | 特定的细胞培养基,通常添加10%胎牛血清 |
| 培养条件 | 37°C,5% CO2,pH 7.2-7.4 |
| 传代信息 | 每2-3天传代一次,80%汇合度时消化传代;胰酶消化1~2分钟 |
| 接种密度 | 2-4×10^4 cells/cm^2 |
| 表达蛋白/标志物 | 甲状腺球蛋白(TG)、甲状腺过氧化物酶(TPO)、钠/碘共转运体(NIS);细胞角蛋白(Cytokeratin) |
| 激素反应性 | 对甲状腺刺激激素(TSH)有反应; |
| 代谢能力 | 保留正常甲状腺细胞的碘摄取和代谢能力 |
| 癌基因突变 | 无BRAF V600E或RAS突变 |
| 保存/运输条件 | 低温避光保存;干冰运输 |
| 可转染性 | 可用于构建稳定表达外源基因的细胞系 |
| 质量控制 | 已通过STR鉴定确认细胞系的真实性 |
培养教程
Nthy-ori 3-1人甲状腺正常细胞培养教程
细胞复苏
解冻:将冻存的 Nthy-ori 3-1 细胞在 37°C 水浴中快速解冻。
混合:缓慢将 Nthy-ori 3-1 细胞悬液加入预热的培养基中。
离心:以 1000 rpm 离心 5 分钟去除冻存液,重悬 Nthy-ori 3-1 细胞。
接种:将 Nthy-ori 3-1 细胞接种到培养瓶中,确保均匀分布。
常规培养
接种密度:2-4 × 10⁴ Nthy-ori 3-1 细胞/cm²。
细胞形态观察:观察 Nthy-ori 3-1 细胞形态,细胞应呈圆形、椭圆形或不规则形状。
培养基更换:每 2-3 天更换 Nthy-ori 3-1 细胞的培养基,去除代谢废物。
传代
传代时机:当 Nthy-ori 3-1 细胞达到 80% 汇合度时进行传代。
洗涤:用无钙镁的 PBS 缓冲液轻轻清洗 Nthy-ori 3-1 细胞。
消化:加入适量胰酶,在 37°C 消化 1-2 分钟,轻轻拍打培养瓶,观察 Nthy-ori 3-1 细胞脱落情况。
终止消化:加入含血清的培养基以终止消化。
收集:离心收集 Nthy-ori 3-1 细胞,按 1:2 或 1:3 的比例重新接种。
细胞冻存
冻存液:使用 90% 培养基 + 10% DMSO 作为 Nthy-ori 3-1 细胞的冻存液。
细胞密度:冻存时 Nthy-ori 3-1 细胞密度约为 1 × 10⁶ cells/mL。
降温:缓慢降温,最终将 Nthy-ori 3-1 细胞保存在液氮中。
注意事项
无菌操作:确保所有操作在无菌条件下进行,以避免 Nthy-ori 3-1 细胞污染。
观察细胞:定期观察 Nthy-ori 3-1 细胞形态和生长状况,确保其处于最佳状态。
消化时长:避免过度消化,以免损伤 Nthy-ori 3-1 细胞。
稳定环境:保持 Nthy-ori 3-1 细胞培养条件的稳定性。
质量控制
纯度检测:定期进行短串联重复序列(STR)鉴定,确保 Nthy-ori 3-1 细胞系的纯度和真实性。
污染检测:检测可能的微生物污染,确保 Nthy-ori 3-1 细胞培养的可靠性。
Nthy-ori 3-1 细胞纯度的重要性
Nthy-ori 3-1 细胞的纯度对培养效果和实验结果的可靠性至关重要。高纯度的 Nthy-ori 3-1 细胞能够更准确地反映人甲状腺正常细胞的特性和功能,通常规格为 1 × 10⁶ cells/T25 培养瓶。
高纯度的益处:高纯度 Nthy-ori 3-1 细胞有助于保持细胞的正常形态和功能,如甲状腺特异性蛋白的表达和激素反应性。
低纯度的风险:可能导致其他细胞类型的混入,影响 Nthy-ori 3-1 细胞的生长速度和特性表达。
纯度对培养参数的影响:可能需要根据 Nthy-ori 3-1 细胞的纯度调整传代比例和生长条件。
相关资料
STR鉴定及相关
| Amelogenin | X |
| CSF1PO | 12 |
| D3S1358 | 14,16 |
| D5S818 | 11 |
| D7S820 | 7,12 |
| D8S1179 | 12 |
| D13S317 | 11 |
| D16S539 | 12,13 |
| D18S51 | 14 |
| D21S11 | 29,30 |
| FGA | 21,22 |
| TH01 | 7 (ECACC=90011609; PubMed=21868764) |
| 7,9.3 (PubMed=30737244) | |
| TPOX | 9 |
| vWA | 16,18 |
参考文献
- Infection of rodent myeloma Y3-Ag 1.2.3 cells by Trypanosoma cruzi metacyclic trypomastigotes J Parasitol . 1984 Dec;70(6):1005-7.
- 摘要:No abstract available
- Nucleotide sequence of Y3-Ag 1.2.3. rat myeloma immunoglobulin kappa chain cDNA Nucleic Acids Res . 1989 Oct 11;17(19):7992. doi: 10.1093/nar/17.19.7992.
- 摘要:No abstract available
- DPT、SPON1基因过表达对人肝癌细胞SK-Hep-1、HepG2增殖及侵袭迁移的影响 《广州医科大学》 2018年
- 摘要:...及肝癌细胞的转染:将DPT、SPON基因慢病毒表达载体pLenti6.3-DPT-I...
- 查看完整内容 >

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值