 货号:STM-CL-8226 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-8226 规格:1×10⁶cells/T25培养瓶或1mL冻存管
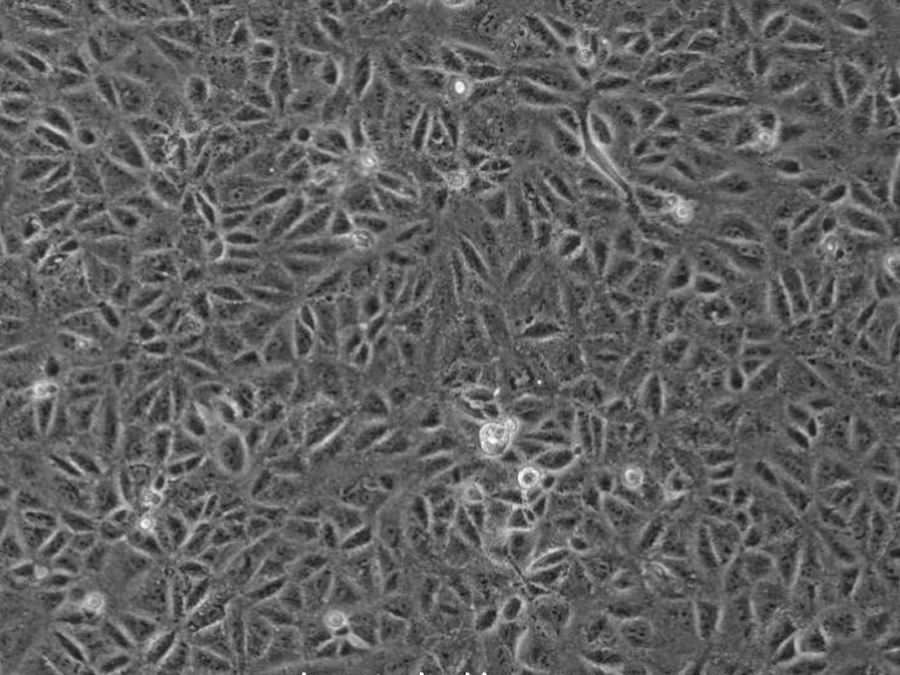
CV-1细胞(非洲绿猴肾细胞)
- 来源:正常肾
- 细胞特征:贴壁细胞,成纤维细胞样
- 培养基:MEM(ATCC改良)+10% FBS+1% P/S
- 其他:CV-1细胞特别适合作为基因转染的宿主,尤其是通过SV40载体的转染。SV40病毒载体的转染实验在CV-1细胞中有较高的成功率
CV-1细胞系是从一只成年雄性非洲绿猴(学名:Chlorocebus aethiops)的肾组织中分离出的细胞系,由Jensen等人于1964年建立。CV-1细胞系广泛应用于病毒学和细胞生物学研究,用在Rous肉瘤病毒转化实验中。CV-1细胞系具备较强的适应性和增殖能力,也用于转染实验,是SV40载体的理想宿主。
CV-1细胞特性特征
染色体特征:CV-1细胞系为假二倍体,其模式染色体数目为60,48%的细胞中观察到该数目。多倍体率为4.4%。在细胞中发现了多个标记,包括可能缺失的N11和未知来源的M3等。
基因组特征:N11和N16在大多数细胞中均为单拷贝,同时检测到X和Y染色体。
CV-1细胞对多种病毒表现出易感性,包括:人类脊髓灰质炎病毒1型、单纯疱疹病毒、东部马脑炎病毒、西马脑炎病毒、加利福尼亚脑炎病毒、SV40病毒、SARS冠状病毒(SARS-CoV)
转染宿主:CV-1细胞适合通过SV40载体进行转染,被广泛应用于基因转染实验。
病毒研究:CV-1细胞常用于病毒的生产和效能测试,以及其他病毒学实验
CV-1细胞参数表
| 细胞名称 | CV-1细胞(非洲绿猴肾细胞) |
| 细胞别称 | Cv-1; CV 1; CV-1.K; CV1 |
| 细胞来源 | Chlorocebus aethiops成年雄性非洲绿猴的肾脏组织 |
| 建立时间 | 1964年,由Jensen等人建立 |
| 供体信息 | 141天雄性非洲绿猴 |
| 细胞形态 | 成纤维细胞样,贴壁生长 |
| 培养基 | MEM(ATCC 改良)+10% FBS+1% P/S |
| 培养条件 | 温度:37°C,CO₂浓度:5% |
| 传代方式 | 胰酶消化 |
| 传代比例 | 1:2至1:4 |
| 换液频率 | 每周2-3次 |
| 冻存条件 | 90%胎牛血清 + 10% DMSO |
| 生物安全等级 | 1,操作需在二级生物安全台内进行 |
| 质量检测 | 无细菌、真菌、支原体污染,所有检测均为阴性 |
| 染色体特征 | 假二倍体,模式染色体数目为60,48%的细胞中观察到 |
| 多倍体率 | 4.4%,在细胞中发现多个标记 |
| X/Y染色体检测 | X和Y染色体均被检测到,所有细胞中均存在 |
| 病毒易感性 | 人类脊髓灰质炎病毒1型、单纯疱疹病毒、东部马脑炎病毒、西马脑炎病毒、加利福尼亚脑炎病毒、SV40病毒、SARS冠状病毒(SARS-CoV) |
| 生长特性 | 贴壁生长,适合在标准培养条件下繁殖。 |
| 基因特征 | N11和N16在大多数细胞中均为单拷贝。 |
| 标记特征 | 发现了几个标记,包括可能缺失的N11和未知来源的M3等。 |
培养教程
CV-1非洲绿猴肾细胞培养教程
CV-1细胞复苏步骤
解冻:将冻存的CV-1细胞从液氮中取出,迅速置于37°C水浴中,轻轻摇动,约1-2分钟完全解冻。
初步培养:将解冻后的CV-1细胞悬液转移至含10% FBS的培养基中,并轻轻混匀,以减少渗透压的变化对细胞的影响。
离心去除冷冻保护剂:以1000 rpm离心5分钟,弃去上清液。
重新悬浮和接种:用新鲜培养基重悬CV-1细胞,并接种至适当的培养瓶中(如T25或T75瓶),置于培养箱中恢复生长。
CV-1细胞的传代方法
观察细胞状态:在显微镜下检查CV-1细胞的形态,确保其健康、无污染。
更换培养基:通常每3天更换一次培养基,以确保CV-1细胞所需的营养充足。
使用0.25%的胰酶溶液,处理CV-1细胞3-5分钟,观察细胞是否开始脱落。
轻轻吹打培养瓶,以促进CV-1细胞的完全分离。
传代比例:根据细胞密度,可选择1:2至1:4的比例进行传代,确保CV-1细胞在新的培养瓶中充分生长。
重新接种:将消化后的CV-1细胞重悬于新鲜培养基中,移至新的培养瓶中。
CV-1细胞的冷冻保存
选择对数生长期的CV-1细胞:在细胞生长的对数期进行冷冻保存,以确保较高的活性。
冷冻液:使用90% FBS和10% DMSO的冷冻保护液。
分装:将CV-1细胞悬液分装到冻存管中,标记清楚。
逐步降温:先将冻存管置于-80°C冰箱中,24小时后转移至液氮中长期保存。

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值 
