 货号:STM-CE-3408 规格:5×10⁵cells/T25细胞培养瓶
货号:STM-CE-3408 规格:5×10⁵cells/T25细胞培养瓶
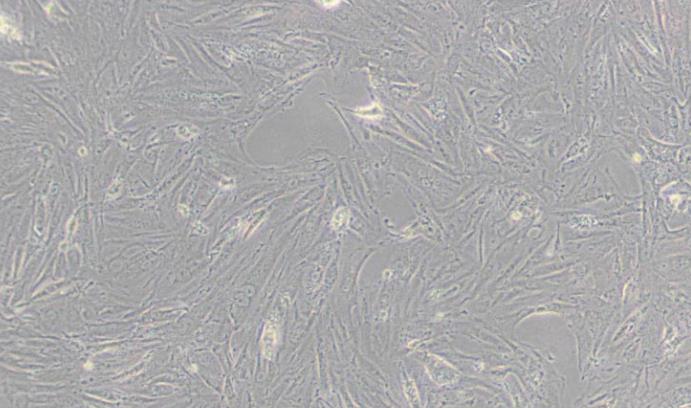
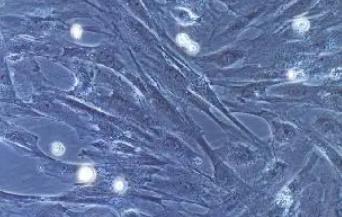
大鼠骨骼肌原代细胞
- 来源:骨骼肌组织
- 细胞特征:贴壁 , 成纤维细胞样
- 培养基:原代细胞专用培养基
- 其他:分化后基因表达稳定性维持10天,优于永生细胞系
大鼠骨骼肌原代细胞主要来自四肢肌肉组织。大鼠骨骼肌细胞为长柱状、多核细胞,其细胞核沿细胞膜排列,细胞内则平行排列着细丝状的肌原纤维,呈现出明显的横纹结构。肌原纤维上,浅色的Ⅰ带与深色的A带交替分布,A带中央存在较亮的H线及其中心的M线,而Ⅰ带中央则由较暗的Z线分隔成肌节,构成了肌肉收缩的基本单位。
大鼠骨骼肌原代细胞(Primary Rat Skeletal Muscle Cells,英文缩写RSkMC4)系从健康大鼠肢体骨骼肌组织中,通过采用复合酶消化法(通常联合使用I/II/IV型胶原酶与Dispase)分离获得,并经过70μm滤网过滤以提升细胞纯度。骨骼肌细胞在无血清培养液重悬下可减少分化抑制,从而提高细胞活性。由于原代细胞在基因表达谱上与永生化细胞系存在显著差异,原代细胞更适合于生理机制的探讨,而诸如L6细胞系则适于高通量代谢实验。
原代大鼠骨骼肌细胞特性特征
细胞形态:呈纤维状,不分支,有明显横纹。
核位置:多核,核位于细胞膜下方。
细胞排列:具有方向性,呈梭形或长梭形,平行排列。
传代能力:可传3-5代。
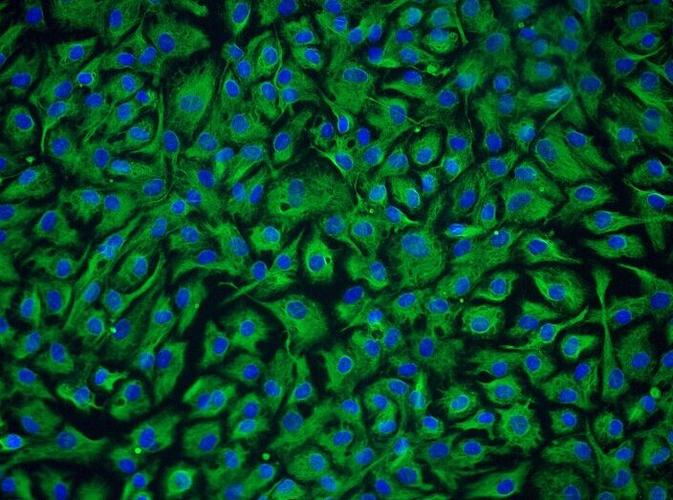
免疫荧光鉴定:α-肌动蛋白(α-actin)免疫荧光染色阳性,纯度高于90%。
其他相关蛋白:可能表达肌球蛋白等肌肉特异性蛋白。
肌肉特异性蛋白:表达肌动蛋白、肌球蛋白等特异性蛋白。
代谢特征:具有较高的胰岛素敏感性,适合用于研究肌肉代谢调控。
基因表达谱:与永生化细胞系(如L6)相比,原代细胞的基因表达谱更接近自然状态,适合用于研究肌肉生理机制。
研究应用:适用于肌肉生理、疾病模型构建、药物筛选等领域。
实验特点:在高通量代谢实验中不如永生化细胞系,但在研究肌肉生理机制时更具优势
分子特征
| 特征类型 | 具体表现 | 比较优势 |
| 收缩蛋白表达 | 表达α-肌动蛋白(>90%)、肌球蛋白,但显著低于成熟肌肉组织 | 较永生细胞系(如L6)更接近天然肌肉结构,但低于C2C12细胞系 |
| 代谢相关基因 | GLUT4表达水平中等,低于L6细胞(胰岛素敏感性EC50低30%) | 适合研究基础代谢调控,但高通量代谢实验推荐使用L6细胞系 |
| 分化标志物 | MyoD、Myogenin动态表达,分化阶段MYOD1/CKM表达稳定性优于L6 | 分化后基因表达稳定性维持10天,优于永生细胞系 |
功能特性对比
| 参数 | 原代细胞 | L6细胞系 | C2C12细胞系 |
| 葡萄糖摄取率 | 12.3±1.2 nmol/min/mg | 18.5±2.1 nmol/min/mg | 15.8±1.5 nmol/min/mg |
| 肌管收缩响应性 | 中等(EPS诱导+40%) | 低(+15%) | 最佳(+65%) |
| 基因表达保真度 | 天然谱系保持度>85% | 异常激活通路>30% | 物种特异性偏差明显 |
大鼠骨骼肌原代细胞参数表
| 细胞名称 | 大鼠骨骼肌原代细胞 |
| 英文名称 | Primary Rat Skeletal Muscle Cells |
| 组织来源 | 四肢骨骼肌组织(采用活检针精准取样) |
| 细胞形态 | 成纤维细胞样/纤维状,有明显横纹结构 |
| 核特征 | 多核,核沿细胞膜下呈线性排列 |
| 培养基 | 原代细胞专用培养基 |
| 消化酶体系 | I/II/IV型胶原酶 + Dispase酶(4℃过夜消化) |
| 纯化方法 | 差速贴壁法(首次2h+二次1h) |
| 初始接种密度 | 0.5×10^6 cells/瓶 |
| 传代比例 | 1:2至1:3 |
| 传代频率 | 当细胞融合度达到70-80%时传代 |
| 换液频率 | 每2-3天换液一次 |
| 结构蛋白 | α-肌动蛋白(阳性率>90%) |
| 肌卫星标记 | Pax7(流式检测纯度>97.6%)、Desmin(>90%) |
| 分化标记 | MyoD、生肌素(Myogenin) |
| 活性检测 | 台盼蓝拒染率≥95% |
| 无菌检测 | 细菌/真菌/支原体阴性 |
| 种属验证 | 大鼠特异性基因PCR阳性 |
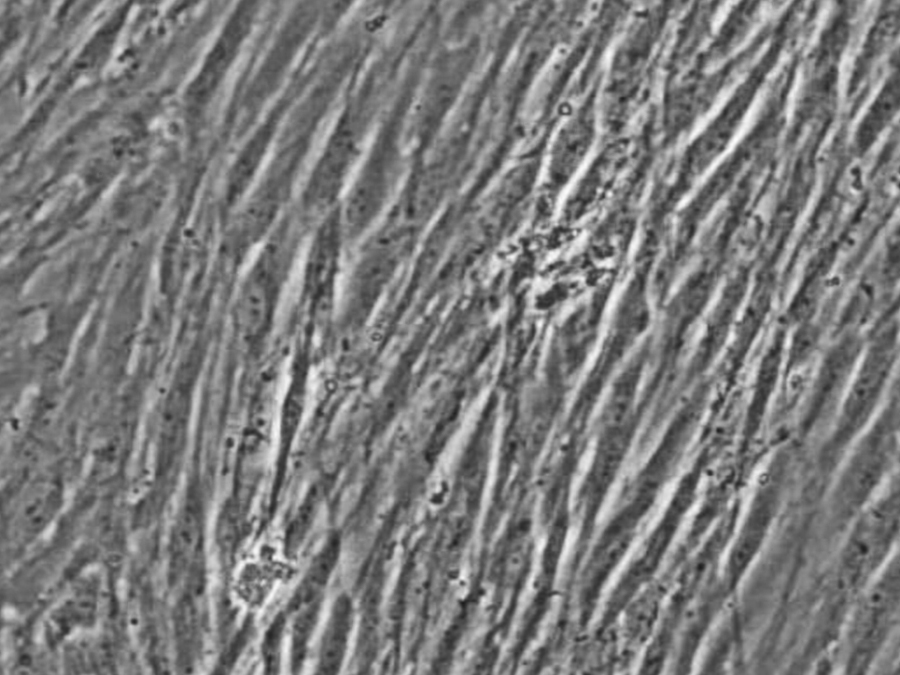
| 功能验证 | 形成多核肌管(自发节律性收缩) |
| 冻存液配方 | 55%基础培养基 + 40% FBS + 5% DMSO |
| 增殖能力 | 第3天进入对数生长期,5-6天达平台期 |
| 分化特性 | 成肌分化率>80%(诱导后肌管形成率) |
| 药物敏感性 | 对胰岛素敏感(EC50较L6细胞低30%) |
| 基因表达保真度 | 保持天然基因表达谱 |
| 代谢功能 | 葡萄糖摄取率:12.3±1.2 nmol/min/mg |
培养教程
大鼠骨骼肌原代细胞培养教程
骨骼肌细胞复苏
从液氮中取出预冻保存的骨骼肌细胞冻存管,迅速放入37℃水浴中解冻。整个解冻过程中需轻柔摇动,确保骨骼肌细胞均匀受热,但避免剧烈震荡,以降低对骨骼肌细胞的损伤风险。
待骨骼肌细胞完全解冻后,立即加入含10%胎牛血清的DMEM培养基,快速稀释细胞悬液中的DMSO。混合均匀后,将骨骼肌细胞悬液转入15 mL离心管中,以1000 RPM离心4分钟,弃去上清液,从而有效去除DMSO,保护骨骼肌细胞活性。
用1~2 mL新鲜培养基轻柔重悬骨骼肌细胞,确保细胞充分分散。随后,将重悬后的骨骼肌细胞接种于T25培养瓶中,补加约8 mL培养基,并置于37℃、5% CO₂培养箱中,过夜培养使骨骼肌细胞稳定贴壁生长。
骨骼肌细胞传代
在传代前,应观察骨骼肌细胞的生长状态,当细胞融合度达到70%~80%时为最佳传代时机。此时,先更换新鲜培养基以清除培养过程中产生的代谢废物和未贴壁的细胞,确保骨骼肌细胞处于最佳状态。
使用0.25%胰蛋白酶对骨骼肌细胞进行消化,消化时间约为5~10分钟,直至骨骼肌细胞开始脱离培养瓶底。消化过程中应随时观察,防止骨骼肌细胞因消化过度而受损。
将消化后的骨骼肌细胞悬液转入离心管中,以1000 RPM离心4分钟后弃去上清液。利用新鲜培养基将骨骼肌细胞轻柔重悬,根据实验要求调整接种密度(常设为0.5×10⁶ cells/mL),并播种于新培养瓶中,确保骨骼肌细胞均匀分布并维持良好的生长状态。
骨骼肌细胞冻存
在传代过程中,将胰蛋白酶处理后的骨骼肌细胞收集于离心管中,利用血球计数板进行计数,确定冻存所需的细胞数。一般建议冻存密度设定在1×10⁶至1×10⁷个活细胞/mL,以确保每管骨骼肌细胞数量充足。
以1000 RPM离心3~5分钟去除上清液后,配制冻存液。常用冻存液比例为60%培养基、30% FBS和10% DMSO,此配方可有效保护骨骼肌细胞在低温下免受冰晶损伤。
将离心后的骨骼肌细胞均匀重悬于冻存液中,并分装到冻存管中,每管内含1×10⁶至1×10⁷个活细胞。
将装有骨骼肌细胞的冻存管置于程序降温盒中,在-80℃冰箱中过夜,使温度逐步降低,随后转移至液氮容器中长期保存,以保证骨骼肌细胞活性长期维持。
STR鉴定及相关
参考文献
- L6大鼠成肌细胞胰岛素信号传导通路中磷脂酰肌醇3激酶、蛋白激酶B和葡萄糖转运蛋白4的表达 获取原文 《中国组织工程研究》|2011年第2期|313-316|共4页
- 摘要:...素+血管紧张素Ⅱ组(P < 0.05).结果显示,血管紧张素Ⅱ在骨骼肌细胞中通...
- 马度米星铵致H9c2细胞和C2C12骨骼肌细胞毒性作用机制研究 《南京农业大学》 2015年
- 摘要:探讨马度米星铵对心肌和骨骼肌细胞的毒性作用机制,本研究采用H9c2和C2C12细胞作为模型...
- LTBP2在镉致16HBE细胞毒性损伤中的作用 《广州医科大学》 2019年收藏 |
- 摘要:...作用:氧化应激、抑制DNA损伤修复、DNA异常甲基化、抑制细胞凋亡、影响细胞周期调控...
- 查看完整内容 >
上一篇:原代大鼠胎盘间充质干细胞
下一篇:大鼠脂肪干细胞(原代细胞)

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值