 货号:STM-CL-5160 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-5160 规格:1×10⁶cells/T25培养瓶或1mL冻存管
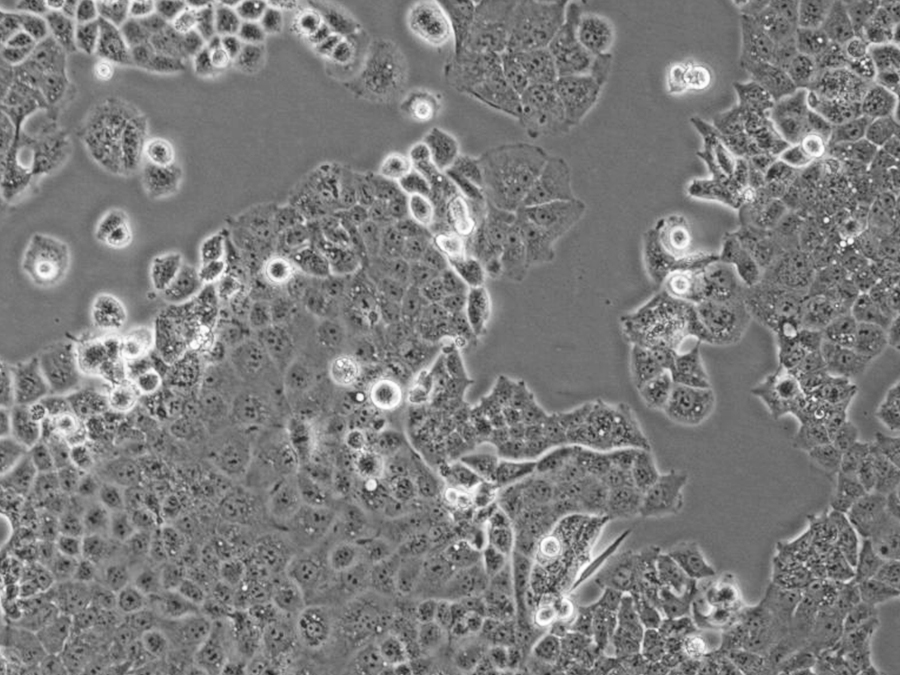
HEC-1-A细胞(人子宫内膜腺癌细胞)
- 来源:腺癌;子宫;子宫内膜炎
- 细胞特征:贴壁细胞 , 上皮细胞样
- 培养基:生长培养基:McCoy’s 5A+10% FBS+1% P/S
- 其他:HEC-1-A 细胞系应用于妇科癌症研究,特别是研究子宫内膜癌
HEC-1-A细胞及其亚株HEC-1-B细胞是由H·Kuramoto等于1968 年从IA期子宫内膜癌患者身上分离。HEC-1-A细胞表达肿瘤基因c-fos,并对血小板活化因子(PAF) 诱导表达。
HEC-1-A细胞特性
HEC-1-A细胞是一种亚二倍体到超二倍体细胞系,模态数为 47。
HEC-1-A细胞是致瘤的,在裸鼠中形成中等分化的腺癌,类似于子宫内膜癌(II 级),在可的松治疗的仓鼠颊袋中形成典型的乳头状腺瘤。
肿瘤基因表达:c-fos 阳性。
PAF(血小板活化因子)可以诱导HEC-1-A细胞c-fos表达。
抗原表达:B型血;Rh+
同工酶表达:AK-1, 1;ES-D, 1;G6PD, B;GLO-I, 2;Me-2, 1;PGM1, 1;PGM3, 1-2。
HEC-1-A细胞用于妇科癌症,特别是子宫内膜癌的研究。
HEC-1-A细胞参数表
| 细胞名称 | HEC-1-A细胞(人子宫内膜腺癌细胞) |
| 别称 | Hec-1-A; HEC-1A; HEC1-A; HEC1A; Hec1A |
| 种属 | 人 |
| 细胞形态 | 上皮细胞样 |
| 生长特性 | 贴壁细胞 |
| 背景描述 | HEC-1-A 细胞及其亚株 HEC-1-B 细胞是 H·Kuramoto 及其同事于 1968 年从一位 I A 期子 宫内膜癌患者身上分离得到的。 |
| 年龄(性别) | 女性;71 岁 |
| 组织来源 | 腺癌;子宫;子宫内膜炎 |
| 细胞类型 | 肿瘤细胞 |
| 肿瘤类型 | 子宫内膜腺癌 |
| 生物安全等级 | BSL-1 |
| 倍增时间 | ~27-36 小时 |
| 致瘤性 | 是的,在裸鼠中(细胞形成与子宫内膜癌(II级)一致的中等分化腺癌)。是的,在可的松治 疗的仓鼠的颊袋中(细胞形成典型的乳头状腺瘤)。 |
| 受体表达情况 | 血小板活化因子 (PAF) |
| 抗原表达情况 | Blood Type B; Rh+ |
| 基因表达情况 | c-fos+ |
| 同工酶 | AK-1, 1;ES-D, 1;G6PD, B;GLO-I, 2;Me-2, 1;PGM1, 1;PGM3, 1-2 |
| 冻存条件 | 冻存液:55% 基础培养基+40% FBS+5% DMSO;温度:液氮 |
| 培养基 | McCoy’s 5A+10% FBS+1% P/S |
| 培养条件 | 气相:空气,95%;CO2,5%;温度:37℃ |
| 推荐传代比例 | 1:3-1:4 |
| 推荐换液频率 | 2-3 次/周 |
| 保藏机构 | ATCC; HTB-112; BCRC; 60552; JCRB; JCRB1117; JCRB; NIHS0388 |
培养教程
HEC-1-A人子宫内膜腺癌细胞培养教程
细胞复苏
将含有1 mL细胞悬液的冻存管在37℃水浴中迅速摇晃解冻。
加入5 mL培养基混合均匀。
在1000 RPM条件下离心5分钟,弃去上清液。
补加4-6 mL培养基后吹匀。
将所有细胞悬液加入培养瓶中或6 cm培养皿中培养过夜。
第二天换液并检查细胞密度。
细胞传代
当HEC-1-A细胞密度达80%-90%时,可进行传代。
弃去培养上清,用不含钙、镁离子的PBS润洗细胞1-2次。
加1-2 mL消化液(0.25% Trypsin-0.53 mM EDTA)于培养瓶中,置于37℃培养箱中消化1-2分钟。
观察细胞消化情况,若细胞大部分变圆并脱落,迅速取出培养瓶。
加5 mL以上含10%血清的培养基终止消化。
轻轻吹打HEC-1-A细胞使其脱落,吸出细胞悬液,在1000 RPM条件下离心8-10分钟,弃去上清液。
补加1-2 mL培养基后吹匀,按5-6 mL/瓶补加培养基。
将细胞悬液按1:2到1:5的比例分到新的培养皿或培养瓶中。
细胞冻存
传代至80%-90%密度,弃去培养基,用PBS润洗细胞1-2次。
加入消化液消化细胞,消化后加入含10% FBS的培养基终止消化。
吸出细胞悬液,在1000 RPM条件下离心5分钟,弃去上清液。
将细胞重悬于冻存液中(55%培养基+40% FBS+5% DMSO),分装至冻存管中。
将冻存管放入程序降温盒中,置于-80℃冻存24小时后移入液氮中长期保存。
相关资料
STR鉴定及相关
| Amelogenin | X |
| CSF1PO | 10,12 (ATCC=HTB-112; Technion Genomics Center BCF; IdentiCell) |
| 10,13 (JCRB=JCRB1117) | |
| D1S1656 | 18.3,19 |
| D2S441 | 11,13 |
| D2S1338 | 18,19 |
| D3S1358 | 15 |
| D5S818 | 11,12,15,16 (JCRB=JCRB1117) |
| 11,14,15 (ATCC=HTB-112) | |
| 11,15 (Technion Genomics Center BCF; IdentiCell) | |
| D7S820 | 9,11 |
| D8S1179 | 13,14 |
| D10S1248 | 12,14 |
| D12S391 | 19 |
| D13S317 | 9,11,14 (IdentiCell) |
| 11 (Technion Genomics Center BCF) | |
| 11,14 (JCRB=JCRB1117) | |
| 11,12 (ATCC=HTB-112) | |
| D16S539 | 12 (Technion Genomics Center BCF; IdentiCell) |
| 12,13 (ATCC=HTB-112; JCRB=JCRB1117) | |
| D18S51 | 16,21 |
| D19S433 | 13 |
| D21S11 | 30,31 |
| D22S1045 | 11,15 |
| FGA | 21,22 |
| Penta D | 9,12 |
| Penta E | 11 |
| TH01 | 6,7 |
| TPOX | 8,11 |
| vWA | 18,19 (ATCC=HTB-112; Technion Genomics Center BCF) |
| 18,19,20 (IdentiCell) | |
| 19,23 (JCRB=JCRB1117) |

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值 
