 货号:STM-CL-5161 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-5161 规格:1×10⁶cells/T25培养瓶或1mL冻存管
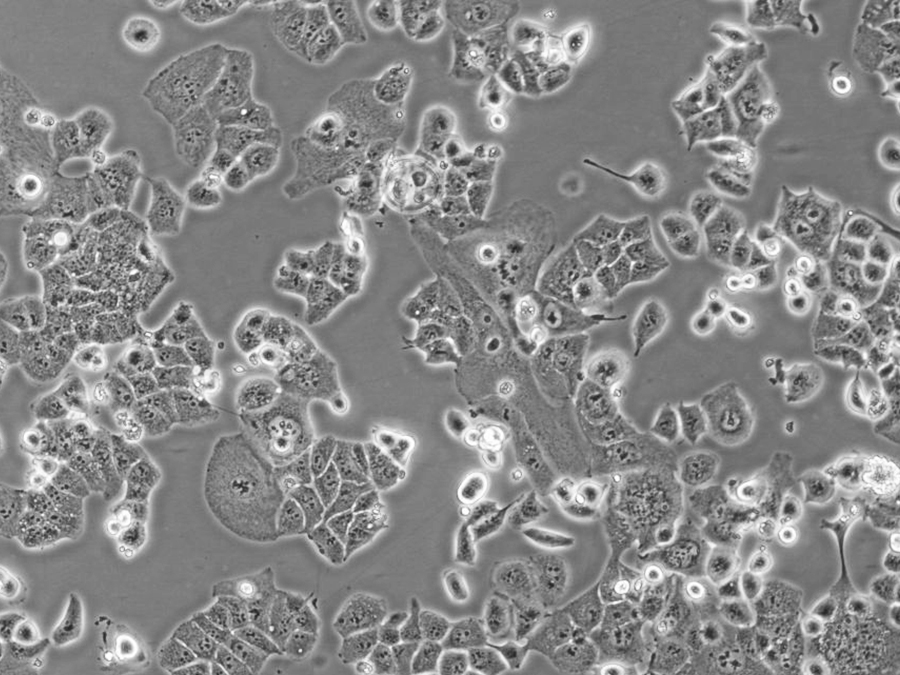
HEC-1-B细胞(人子宫内膜腺癌细胞)
- 来源:子宫内膜腺癌
- 细胞特征:贴壁细胞 , 上皮细胞样
- 培养基:MEM(含NEAA)+10% FBS+1% P/S
- 其他:HEC-1-B细胞的主要染色体组是亲本细胞HEC-1-A细胞的两倍。
HEC-1-B细胞是从HEC-1-A细胞分离而来的亚株。相比于亲本细胞系HEC-1-A细胞,HEC-1-B细胞在培养第135天到190天之间展现出稳定的生长周期,并呈现扁平生长形态,表现出更强的铺路石样特征。
HEC-1-B细胞特性
HEC-1-B细胞是由H·Kuramoto于1968年分离的HEC-1-A细胞的亚株。
HEC-1-B细胞的主要染色体组是亲本细胞HEC-1-A细胞的两倍。
HEC-1-B细胞具有大的亚中心标记的二倍体到四倍体。
HEC-1-B细胞在裸鼠体内具有致瘤性,形成中等分化的腺癌,与子宫内膜癌(II级)相符。
抗原表达:B型血;Rh+。
同工酶:AK-1,1;ES-D,1;G6PD,B;GLO-I,2;Me-2,2;PGM1,1;PGM3,1-2。
HEC-1-B细胞参数表
| 细胞名称 | HEC-1-B细胞(人子宫内膜腺癌细胞) |
| 别称 | Hec-1-B; HEC-1B; HEC1-B; HEC1B |
| 种属 | 人 |
| 细胞类型 | 肿瘤细胞 |
| 细胞形态 | 上皮细胞样 |
| 生长特性 | 贴壁细胞 |
| 抗原表达情况 | Blood Type B; Rh+ |
| 主要染色体组 | 是亲本细胞的两倍 |
| 年龄(性别) | 女性;71岁 |
| 组织来源 | 子宫内膜腺癌 |
| 冻存条件 | 冻存液:55% 基础培养基 + 40% FBS + 5% DMSO,温度:液氮 |
| 细胞来源 | HEC-1-B细胞是从HEC-1-A细胞亚株中分离出来的 |
| 致瘤性 | 在裸鼠中具有致瘤性,形成中等分化的腺癌(与子宫内膜癌(II级)一致),在类固醇治疗的仓鼠中也能形成瘤。 |
| 培养方案 | 生长培养基:MEM(含NEAA)+ 10% FBS + 1% P/S |
| 培养条件 | 气相:空气,95%;CO2,5%;温度:37℃ |
| 推荐传代比例 | 1:2 - 1:4 |
| 推荐换液频率 | 2-3次/周 |
| 培养基 | MEM(含NEAA)+10% FBS+1% P/S |
| 细胞染色体数目 | 大的亚中心标记的二倍体到四倍体 |
| 转染宿主 | 适合用作转染宿主 |
| 三维细胞培养 | 可用于3D细胞培养 |
| 生物安全等级 | BSL-1 |
| 收录机构 | ATCC; HTB-113 JCRB; JCRB1193 JCRB; NIHS0480 |
培养教程
HEC-1-B人子宫内膜腺癌细胞培养教程
细胞状态检查
解冻后需检查细胞生长状态,确保无细菌和支原体污染。
细胞应贴壁于培养皿或烧瓶底部,培养基呈粉橙色。
使用pH指示剂(如酚红)观察培养基的酸化情况。
切换到相衬显微镜以便更清楚地观察细胞。
细胞复苏
吸走培养基到废物容器或真空吸液器中。
使用预热的不含Ca和Mg的PBS小心洗涤细胞最多3次,以去除残留培养基中的FBS。
加入含EDTA的胰蛋白酶轻轻溶解细胞并在37°C孵育。
离心分离细胞沉淀,去除胰蛋白酶。
加入培养基使HEC-1-B细胞复苏。
冻存操作
消化并离心HEC-1-B细胞,加入配置好的冻存液轻轻悬浮。
将悬液尽快转移至标记的冻存管中。
将冻存管首先放入-80°C冰箱过夜,然后转入液氮保存。
传代方法
吸干净T25瓶中的原培养基。
加入PBS轻轻润洗HEC-1-B细胞。
加入胰酶并在37°C培养箱中消化细胞。
加入完全培养基终止胰酶消化。
离心分离并重悬细胞。
分配HEC-1-B细胞到新的培养瓶中。
补充完全培养基并放回培养箱静置培养。
相关资料
STR鉴定及相关
| Amelogenin | X |
| CSF1PO | 10,12 |
| D2S1338 | 18,19 |
| D3S1358 | 15 |
| D5S818 | 11,13 |
| D7S820 | 9,11 |
| D8S1179 | 13,14 |
| D13S317 | 11 (JCRB=JCRB1193; PubMed=25877200) |
| 11,16 (ATCC=HTB-113; CCRID) | |
| D16S539 | 11,12 |
| D18S51 | 16,20 |
| D19S433 | 13 |
| D21S11 | 30,31 |
| FGA | 21 |
| Penta D | 9,13 |
| Penta E | 11 |
| TH01 | 6 (PubMed=25877200) |
| 6,7 (ATCC=HTB-113; CCRID; JCRB=JCRB1193) | |
| TPOX | 8,11 |
| vWA | 18 |
参考文献
下一篇:HT3细胞系(人子宫颈癌细胞系)

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值