 货号:STM-CE-3206 规格:5×10⁵cells/T25细胞培养瓶
货号:STM-CE-3206 规格:5×10⁵cells/T25细胞培养瓶
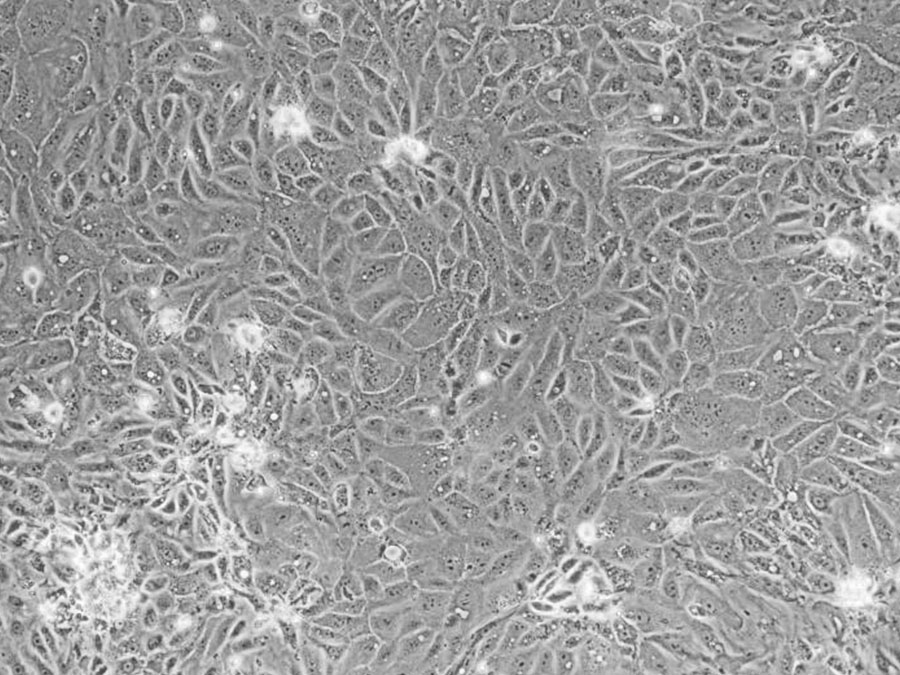
大鼠原代肾小管上皮细胞
- 来源:肾组织
- 细胞特征:贴壁 , 上皮细胞样
- 培养基:原代细胞专用培养基
- 其他:肾小管上皮细胞分泌炎症介质如细胞因子和趋化因子,通过产生IL-8或直接趋化白细胞参与急性炎症反应
大鼠原代肾小管上皮细胞(Rat Primary Renal Tubular Epithelial Cells, RTECs)是从健康大鼠的肾组织中提取,主要来源于肾小管这一细长的上皮性结构,包含近端小管、髓袢和远端小管,各部分在结构和功能上有所不同。近端小管负责重吸收葡萄糖和氨基酸,远端小管则参与电解质和酸碱平衡的调节。
肾小管上皮细胞在重吸收原尿中的营养物质和排泄非营养性物质方面发挥关键作用,还能分泌炎症介质(如细胞因子、趋化因子),参与肾脏免疫反应,表达IL-2受体和MHC II类分子,涉及肾免疫损伤的发生。大鼠原代肾小管上皮细胞广泛用于肾脏疾病机制研究、药物筛选和毒理学研究,是研究肾间质纤维化及其他肾脏病变的重要体外模型。
大鼠原代肾小管上皮细胞特性特征
肾小管上皮细胞表达多种上皮细胞特异性标志物:
角蛋白(CK-18):用于确认其上皮细胞身份。
Na⁺/K⁺-ATP酶:参与电解质的重吸收。
水通道蛋白(AQP1):在水的重吸收中起重要作用。
表达与肾功能相关的基因,如:
SGLT2:负责葡萄糖的重吸收。
NHE3:参与钠离子的重吸收。
ACE(血管紧张素转化酶):与肾脏内分泌功能相关。
表达特征
重吸收功能:大鼠原代肾小管细胞能够重吸收原尿中的几乎全部葡萄糖和氨基酸,显示出其在维持体内代谢平衡中的重要作用。
排泄功能:肾小管上皮细胞能够排泄非营养物质进入终尿,例如尿素和肌酐等废物。
炎症介质分泌:肾小管细胞能分泌多种炎症介质,如细胞因子和趋化因子(例如IL-8),参与急性炎症反应,并在肾免疫损伤中发挥作用。
应对环境变化:肾小管上皮细胞对缺血、感染和毒物等环境变化敏感,能够通过调节相关基因的表达来适应不同的生理状态
大鼠原代肾小管上皮细胞参数表
| 细胞名称 | 大鼠原代肾小管上皮细胞(Rat Primary Renal Tubular Epithelial Cells) |
| 英文名称 | Rat Renal Tubular Epithelial Cells |
| 来源 | 健康大鼠的肾组织 |
| 细胞形态 | 上皮样,铺路石状,贴壁生长 |
| 纯度 | ≥90%(通过免疫荧光鉴定) |
| 主要标志物 | CK-18、Na⁺/K⁺-ATP酶、AQP1 |
| 不含病原体 | 不含HIV-1、HBV、HCV、支原体、细菌、酵母和真菌 |
| 培养基 | 原代细胞专用培养基 |
| 培养条件 | 37℃,5% CO₂,空气中95% |
| 传代频率 | 每2-3天传代一次,达到80%-90%汇合度时进行传代 |
| 消化酶 | 0.25% 胰酶 |
| 培养瓶 | T-25或T-75培养瓶 |
| 冻存液 | 90% 完全培养基 + 10% DMSO |
| 冻存条件 | -80℃过夜后转入液氮长期保存 |
| 重悬浓度 | 1×10^6 cells/mL |
| 冻存管规格 | 1.2ml冻存管 |
| 重吸收功能 | 能够重吸收原尿中的几乎全部葡萄糖和氨基酸 |
| 排泄功能 | 排泄非营养物质进入终尿 |
| 炎症介质分泌 | 能分泌细胞因子和趋化因子(如IL-8) |
| 参与免疫反应 | 在肾炎症和新月体肾炎中表达IL-2R和MHC-II类抗原 |
| 应用领域 | 药物筛选、毒理学研究、肾脏疾病模型研究 |
| 注意事项 | 建议用多聚赖氨酸 PLL(0.1mg/ml)或明胶(0.1%)对接种培养皿包被处理 |
培养教程
大鼠原代肾小管上皮细胞培养教程
收到原代肾小管上皮细胞后的处理
收到原代肾小管上皮细胞时,检查培养瓶的密封性、培养液是否浑浊或漏液。
若是冻存的原代肾小管上皮细胞,需确认干冰是否完全挥发,冻存管是否破损,以保证细胞的存活率。
活细胞:收到T-25培养瓶中的原代肾小管上皮细胞后,用75%酒精消毒瓶表面,放入培养箱静置2-3小时。
冻存细胞:如为冻存的原代肾小管上皮细胞,需尽快转入液氮或-80℃冰箱中保存,准备进行复苏操作。
原代肾小管上皮细胞的复苏
配制适合原代肾小管上皮细胞生长的完全培养基,包括基础培养基(如DMEM/F12)、10%胎牛血清(FBS)和1%双抗。
预热培养基:在37℃水浴中预热5 ml完全培养基。
化冻细胞:快速从液氮或-80℃冰箱取出冻存的原代肾小管上皮细胞,放入37℃水浴中摇晃约1分钟至完全化冻。
离心:将化冻的原代肾小管上皮细胞悬液加入5 ml预热培养基中,置于15 ml离心管中,1000 rpm离心5分钟。
重悬细胞:弃去上清,用2 ml完全培养基重悬原代肾小管上皮细胞,将其接种于T-25培养瓶中培养。
细胞培养:将原代肾小管上皮细胞放入37℃、5% CO₂培养箱中培养,24小时后更换新鲜培养基。
原代肾小管上皮细胞的传代
当原代肾小管上皮细胞生长至80%-90%汇合时,可以进行传代。
吸弃旧的培养基,用1 ml无菌PBS轻柔地洗涤原代肾小管上皮细胞。
加入1 ml 0.25%胰酶,在37℃孵育1-2分钟,观察原代肾小管上皮细胞变圆后,加入1 ml完全培养基终止消化。
轻轻拍打瓶壁使细胞脱落,形成均匀的细胞悬液。
收集悬液至离心管中,1000 rpm离心5分钟,弃去上清。
将沉淀的原代肾小管上皮细胞重悬于适量完全培养基中,分成新培养瓶继续培养。
原代肾小管上皮细胞的冻存
按传代方法收集原代肾小管上皮细胞,并计数。
配制冷冻保护液(90% FBS + 10% DMSO),以保护原代肾小管上皮细胞在冻存过程中不受损伤。
将原代肾小管上皮细胞悬浮于冷冻保护液中,分装于冻存管中,每管约1-5×10⁶ cells/ml。
置于-80℃冰箱中逐渐降温,然后转移至液氮中长期保存。
注意事项
无菌操作:培养原代肾小管上皮细胞时,需在生物安全柜中进行,确保无菌。
培养基更换:及时更换原代肾小管上皮细胞的培养基,每2-3天更换一次,以保持良好状态。
传代频率:根据原代肾小管上皮细胞的生长速度合理安排传代,避免过度消化和稀释。
相关资料
STR鉴定及相关
参考文献
- 刺五加苷B/E对高糖环境下HBZY-1细胞增殖及TGF-β1和PPARγ表达的影响 《中国病理生理杂志》 2015年03期
- 摘要:目的:探讨刺五加苷B/E(ETS-B/E)对高糖环境大鼠肾小球系膜细胞HBZY-1增殖的影...
- T-2毒素对人肾小管上皮细胞HK-2体外增殖和凋亡的影响 《食品与发酵工业》 2019年10期
- 摘要:探讨T-2毒素对人肾小管上皮细胞HK-2体外增殖和凋亡的影响。将体外培养的HK-2细胞,经...
- 玉米须黄酮类成分对HK-2细胞尿酸吸收及相关基因表达的影响 《中药药理与临床》 2020年05期
- 摘要:目的:探讨玉米须总黄酮对人肾小管上皮细胞凋亡及尿酸吸收的作用及其机制。方法:体外培养人肾小...
- 复方丹参注射液减轻缺氧/复氧性HK-2细胞损伤的作用及机制 《中国当代儿科杂志》 2007年06期
- 摘要:...曲小管上皮细胞(HK-2)细胞损伤的作用机制。方法以人近曲肾小管上皮细胞为研究对象,...
- 敲低QDPR基因慢病毒构建及其干涉NRK-52E细胞效果研究 中国煤炭工业医学杂志 > 2014年12期
- 摘要:目的 构建醌型二氢生物碟呤还原酶(quinonoid dihydropteridine r...
- 查看完整内容 >
上一篇:原代大鼠表皮角化细胞
下一篇:原代大鼠尿道上皮细胞

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值 
