 货号:STM-CE-3509 规格:5×10⁵cells/T25细胞培养瓶
货号:STM-CE-3509 规格:5×10⁵cells/T25细胞培养瓶
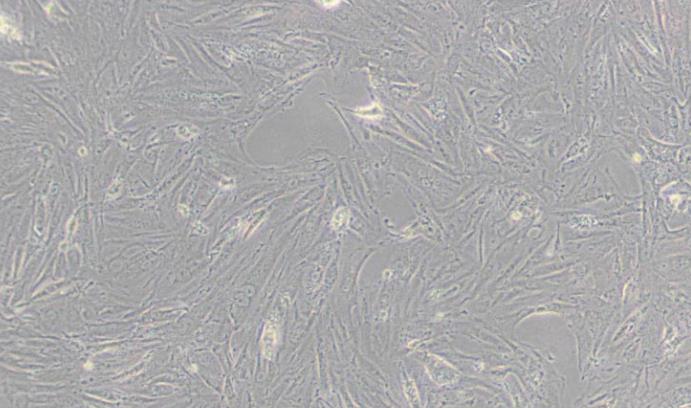
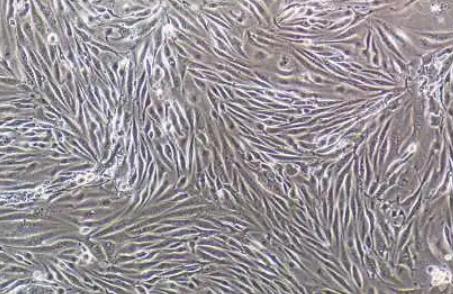
大鼠外周血来源内皮祖细胞(原代内皮祖细胞)
- 来源:外周血
- 细胞特征:贴壁,内皮细胞样
- 培养基:原代细胞专用培养基
- 其他:外周血来源的EPCs表现为晚期内皮祖细胞,基因表达趋向成熟内皮细胞特征
大鼠外周血来源的内皮祖细胞(Endothelial Progenitor Cells, EPCs)是一类源自大鼠循环血液中单个核细胞(Mononuclear Cells, MNCs)的原代细胞,具有血管生成潜能和组织修复能力。通过密度梯度离心法从外周血中分离出MNCs,随后接种于经纤维连接蛋白(Fibronectin)或明胶包被的培养皿中,并在特定的内皮细胞诱导培养基(如EGM-2)中培养,可获得具有高纯度和生理活性的EPCs。
大鼠外周血来源的内皮祖细胞具备迁移性、增殖性及分化为成熟内皮细胞的潜力,但在早期阶段缺乏成熟内皮细胞的典型表型,不能独立形成管腔样结构。尽管相比骨髓来源EPCs,其数量略少且增殖能力有限,但在多种病理过程中,如缺血性心脑血管疾病、外周动脉病变、肿瘤新生血管形成及创伤修复等方面,均展现出显著的生物学活性和治疗潜力。EPCs广泛应用于血管生成机制的研究、药物筛选、肿瘤血管调控机制探讨及组织工程构建等前沿领域,是再生医学与细胞治疗研究的重要细胞模型之一。
大鼠外周血来源内皮祖细胞特性特征
细胞形态:初期呈圆形,培养3-5天后贴壁生长,逐渐形成纺锤形或梭形,呈铺路石样排列。晚期EPCs形态更接近成熟内皮细胞,能形成血管样小管结构。
增殖与迁移能力:具有较强的增殖和迁移能力,晚期EPCs增殖能力较早期EPCs强,外周血来源的EPCs增殖能力较骨髓来源的相对较弱。
功能:不能自行形成管腔样结构(早期EPCs),但能通过分泌血管生成因子促进新生血管形成;晚期EPCs能直接形成血管样结构,参与缺血组织的血管生成和血管损伤修复。
透射电镜观察发现外周血来源内皮祖细胞含有Weibel-Palade小体(W-P小体),这是成熟内皮细胞特有的细胞器
表面标志物:
表达内皮细胞特异性标志物:CD31、CD34、VE-cadherin、KDR(VEGFR-2)、von Willebrand因子(vWF)等。
早期EPCs可能表达CD45(造血细胞标志)较弱,晚期EPCs表达更接近成熟内皮细胞,CD31和vWF表达持续较高。
外周血来源的EPCs为晚期内皮祖细胞,CD31、vWF、Flk-1等成熟内皮标志物表达较高且持续。
功能性鉴定:
能吞噬DiI标记的乙酰化低密度脂蛋白(DiI-Ac-LDL),呈红色荧光。
能结合FITC标记的荆豆凝集素(UEA-1),呈绿色荧光。
双阳性细胞被鉴定为内皮祖细胞。
基因表达:
晚期EPCs表达VE-cadherin、Flt-1、KDR、eNOS、vWF等内皮细胞相关基因,具有较强的一氧化氮(NO)生成能力。
早期EPCs基因表达较杂,逐渐丧失CD45、CD31表达,且VE-cadherin、KDR表达减弱。
大鼠外周血来源内皮祖细胞参数表
| 细胞名称 | 大鼠外周血来源内皮祖细胞(原代内皮祖细胞) |
| 英文名称 | Rat Peripheral Blood-Derived Endothelial Progenitor Cells |
| 细胞名称 | 大鼠外周血来源内皮祖细胞(Rat Peripheral Blood Endothelial Progenitor Cells) |
| 组织来源 | 大鼠外周血单个核细胞(Peripheral Blood Mononuclear Cells, PBMCs)通过密度梯度离心法分离获得。 |
| 细胞形态 | 贴壁生长,纺锤形或梭状排列,呈典型内皮细胞形态,6天左右出现明显细胞群落。 |
| 生物学特性 | 具有迁移、增殖能力,参与血管新生和修复;外周血来源细胞为晚期内皮祖细胞,生物学特性与骨髓来源不同。 |
| 细胞功能 | 参与血管新生和血管损伤修复,具有游走和增殖能力,缺乏成熟内皮细胞管腔形成能力 |
| 内皮祖细胞标志物 | CD34、CD133、Flk-1(VEGFR-2) |
| 成熟内皮细胞标志物 | CD31、von Willebrand因子(vWF) |
| 内吞功能 | 能内吞乙酰化低密度脂蛋白(DiI-Ac-LDL) |
| 结合能力 | 结合荆豆凝集素-1(FITC-UEA-1) |
| 细胞器特征 | 透射电镜下可见Weibel-Palade小体(W-P小体) |
| 血管生成相关基因 | VEGF受体(Flk-1)、vWF、CD31等内皮细胞特异基因 |
| 基因表达差异 | 外周血来源EPCs基因表达趋向成熟内皮细胞,骨髓来源EPCs偏向增殖和未分化状态 |
| 主要功能 | 参与缺血组织血管新生和血管损伤修复 |
| 细胞能力 | 迁移、增殖能力较骨髓来源EPCs弱 |
| 血管形成能力 | 不能单独形成管腔样结构,需分化为成熟内皮细胞后具备管腔形成能力 |
| 细胞总量 | 约5×10⁵ cells / T25培养瓶 |
| 细胞纯度 | CD34阳性免疫荧光鉴定,纯度≥90% |
| 传代能力 | 可传代1-3代,不建议多次传代以保持细胞特性 |
| 细胞生长特性 | 贴壁生长,生长速度适中,需专用培养基维护 |
| 培养基 | 内皮细胞专用完全培养基(含胎牛血清、特定生长因子、青霉素-链霉素等) |
| 包被条件 | 0.1 mg/mL多聚赖氨酸(PLL)或0.1%明胶包被 |
| 培养温度 | 37℃ |
| 培养气体条件 | 5% CO₂,95%空气 |
| 换液频率 | 每2-3天更换一次培养基 |
| 消化液 | 0.25%胰蛋白酶 |
| 细胞密度 | 复苏或传代接种时,建议细胞密度适中,避免过密或过稀 |
| 质量检测 | 不含HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等污染物 |
| 冻存条件 | 细胞冻存液:90%完全培养基 + 10% DMSO,液氮罐中储存 |
| 供应限制 | 仅供科研使用 |
培养教程
原代大鼠外周血来源内皮祖细胞培养教程
EPCS细胞复苏操作流程
将EPCS细胞冻存管自液氮罐中取出,迅速置于37℃水浴中解冻,轻轻摇晃约1~2分钟,直至内容物全部融化。
使用75%乙醇擦拭管外表面后,转入生物安全柜内进行无菌操作。
将细胞悬液缓慢滴入含4 mL预温完全培养基的15 mL离心管中,轻轻混匀以降低DMSO毒性。
以1000 rpm离心4分钟,去除上清。
加入12 mL完全培养基重悬EPCS细胞,并移入预包被0.1 mg/mL多聚赖氨酸(PLL)或0.1%明胶的T25培养瓶中,补足培养基至68 mL。
置于37℃、5% CO₂培养箱培养。次日更换培养基以去除未贴壁细胞。
注意:原代EPCS细胞贴壁较慢,复苏后24小时内不应频繁移动培养瓶,以防影响贴壁效率。
EPCS细胞传代流程
当EPCS细胞汇合度达80%-90%时进行传代(一般每3-4天传代一次)。
弃去培养基,使用无钙镁PBS洗涤2次。
加入1 mL 0.25%胰酶-EDTA,置于37℃下消化1~2分钟,轻敲瓶壁帮助细胞脱落。
加入2倍体积完全培养基终止反应,轻轻吹打混匀。
以1000 rpm离心4分钟,弃上清后重悬EPCS细胞。
按1:2至1:6比例接种至新瓶,补加8 mL新鲜完全培养基,继续培养。
建议每次传代前对EPCS细胞进行显微镜检查,确保细胞形态良好且无污染。
EPCS细胞冻存流程
选择处于对数生长期的EPCS细胞进行冻存操作。
弃去培养基后用PBS洗涤一次,消化收集细胞。
计数细胞浓度,调整至1×10⁶ ~ 2×10⁶ cells/mL。
配制冻存液:90%完全培养基 + 10% DMSO,或使用无血清冻存液。
按1 mL/管分装于冻存管中,标记清楚细胞编号与冻存日期。
将冻存管置入程序降温盒,-80℃预冻2小时后转移至液氮中长期保存。
为保护EPCS细胞活力,应尽量缩短细胞与DMSO接触时间,冻存过程务求迅速规范。
培养条件与注意事项
培养温度:37℃;气体条件:5% CO₂,95%空气。
培养基推荐使用EPCS细胞专用完全培养基,含有VEGF、bFGF等生长因子以维持其祖细胞状态。
全程需无菌操作,定期观察细胞状态。
对于贴壁性不佳或生长缓慢的EPCS细胞,可在包被基质中加入细胞外基质蛋白如fibronectin或collagen以提高粘附性。
定期检测支原体污染,保障EPCS细胞纯净性。
STR鉴定及相关
参考文献
上一篇:原代大鼠肾小球内皮细胞
下一篇:没有了

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值