 货号:STM-CE-2509 规格:5×10⁵cells/T25细胞培养瓶
货号:STM-CE-2509 规格:5×10⁵cells/T25细胞培养瓶
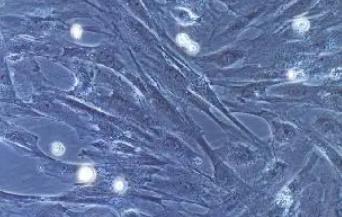
小鼠外周血内皮祖细胞(原代细胞)
- 来源:外周血
- 细胞特征:贴壁细胞 , 内皮细胞样
- 培养基:原代细胞专用培养基
- 其他:小鼠外周血内皮祖细胞EPCs具有较强的游走能力,可以迁移至损伤部位,参与组织修复和再生
小鼠外周血内皮祖细胞(Endothelial Progenitor Cells, EPCs)是血管内皮细胞的重要前体,具有显著的增殖、迁移及分化能力,能够参与血管损伤的修复和再生。外周血内皮祖细胞来源于骨髓,在特定的生理或病理刺激下被动员至外周血中,通过采集外周血样本并采用密度梯度离心法和差速贴壁法进行分离和培养。培养过程中,EPCs呈现不规则或短梭形状,具有良好的贴壁性,并在适宜条件下稳定增殖。作为一种未成熟的内皮细胞,EPCs缺乏成熟内皮细胞的特征性表型,但能够分化为成熟细胞,参与血管新生和缺血组织的再血管化。研究表明,EPCs在心脑血管疾病、外周血管病变、肿瘤血管生成及创伤愈合中发挥重要作用,为缺血性疾病治疗、肿瘤微环境研究及组织再生提供了新思路和潜在应用价值,成为再生医学与细胞治疗领域的研究热点。
小鼠外周血内皮祖细胞特性特征
游走特性:外周血内皮祖细胞EPCs具有游走能力,能够迁移至损伤部位参与血管修复。
表面标志物:外周血内皮祖细胞EPCs通常通过流式细胞术鉴定,常用的表面标志物包括CD31和CD34。CD31是内皮细胞特异性标记,而CD34则是造血干细胞的标记。早期内皮祖细胞表现为CD31阳性和CD45阳性。
基因表达:早期外周血内皮祖细胞EPCs表现出强烈的内皮细胞基因表达,例如VE-cadherin、Flt-1、KDR和e-NOS等。这些基因与内皮细胞的功能密切相关。随着培养时间的延长,早期EPCs逐渐失去CD45和CD31的表达,并弱表达KDR和VE-cadherin。
功能特征:早期EPCs在体外不能形成管腔样结构,但可以促进新生血管生成,主要通过分泌血管因子来招募成熟内皮细胞。
晚期EPCs:晚期外周血内皮祖细胞EPCs具有更强的增殖能力和更高的内皮细胞一氧化氮(NO)生成能力,能够更有效地促进新生血管形成。
小鼠外周血内皮祖细胞参数表
| 细胞名称 | 小鼠外周血内皮祖细胞(原代细胞) |
| 英文名称 | Mouse Peripheral Blood-Derived Endothelial Progenitor Cells |
| 细胞来源 | 小鼠外周血 |
| 组织类型 | 外周血 |
| 细胞形态 | 圆形、短梭形或不规则形状,铺路石样排列 |
| 细胞鉴定 | CD31和CD34免疫荧光染色阳性,纯度高于90% |
| 生长方式 | 贴壁培养 |
| 传代特性 | 可传代2-3代 |
| 培养基 | 原代细胞专用培养基 |
| 培养条件 | 37℃,95%空气,5%二氧化碳 |
| 冻存条件 | 液氮罐保存 |
| 运输条件 | 活细胞常温运输;冻存管干冰运输 |
| 质量检测 | 不含HIV-1、HBV、HCV、支原体、细菌、酵母和真菌等 |
| 细胞数量 | 每支冻存管约5 x 10^5个细胞 |
| 发货规格 | 活细胞:T25培养瓶或1ml冻存管(细胞量约为5 x 10^5) |
| 储存温度 | 活细胞:培养箱;冻存管:液氮罐 |
| 应用领域 | 心脑血管疾病、外周血管疾病、肿瘤血管形成及创伤愈合 |
| 游走特性 | 能够迁移至损伤部位参与修复 |
| 功能特征 | 促进缺血组织的血管发生和损伤后的修复 |
| 基因表达特征 | 表达VE-cadherin、Flt-1、KDR和e-NOS等内皮细胞相关基因 |
| 供应限制 | 仅供科研使用 |
| 注意事项 | 建议用多聚赖氨酸 PLL(0.1mg/ml)或明胶(0.1%)对接种培养皿包被处理 |
培养教程
原代小鼠外周血内皮祖细胞培养教程
细胞复苏
将冻存的小鼠外周血内皮祖细胞从液氮中取出,迅速放入37℃水浴中,轻轻摇晃冻存管,直至细胞完全解冻(约1-2分钟)。
用75%酒精擦拭冻存管表面后,在生物安全柜中操作,确保无菌环境。
将解冻后的外周血内皮祖细胞悬液与4 mL完全培养基(如EGM-2或PCM-M-25)混合,轻轻混匀以降低DMSO浓度。
将稀释的细胞悬液转移至15 mL离心管中,在1000 RPM下离心4分钟,弃去上清液,仅保留细胞沉淀。
补加1-2 mL完全培养基,轻轻吹打混匀小鼠外周血内皮祖细胞沉淀,使其形成均匀的悬液。
将细胞悬液转移至T25培养瓶,加入适量完全培养基,放置于37℃、5% CO₂的培养箱中培养。
第二天检查小鼠外周血内皮祖细胞的贴壁情况和状态,并更换培养基,去除未贴壁的非目标细胞。
细胞传代
当小鼠外周血内皮祖细胞的密度达到80%-90%时,应及时进行传代,以确保细胞的活性和功能。
弃去培养基,用无钙镁离子的PBS润洗1-2次,去除培养基残留物并准备消化。
加入1 mL胰蛋白酶-EDTA溶液(0.25%胰蛋白酶+0.53 mM EDTA),在37℃培养箱中消化1-2分钟。
观察小鼠外周血内皮祖细胞是否变圆并开始脱落,若大部分细胞已松散,立即加入2倍体积完全培养基终止消化,并轻轻吹打使细胞脱落。
将细胞悬液转移至离心管,在1000 RPM下离心4分钟,弃去上清液。
补加适量完全培养基重悬细胞,轻轻吹匀形成均匀悬液。
按1:2或1:3比例将小鼠外周血内皮祖细胞分种至新培养瓶,加入8 mL完全培养基,继续置于培养箱中培养。
细胞冻存
在小鼠外周血内皮祖细胞状态良好且密度适中时,选择传代1-2天后的细胞进行冻存。
弃去培养基,用PBS清洗1次以去除杂质。
按传代步骤进行细胞消化,随后使用血球计数板计数细胞浓度,确保冻存时每管细胞数量在1×10⁶-2×10⁶之间。
制备冻存液(90%胎牛血清+10%DMSO),将其与小鼠外周血内皮祖细胞悬液按比例混合,使DMSO终浓度为10%。
每支冻存管加入1 mL细胞悬液,密封后标记清楚。
将冻存管置于程序降温盒中,-80℃冷冻2小时后转存至液氮罐中长期保存。
记录冻存小鼠外周血内皮祖细胞的编号、来源、冻存时间及位置,以确保后续实验的可追溯性。
注意事项
在整个操作过程中,务必保持无菌条件,避免污染小鼠外周血内皮祖细胞培养环境。
冻存与复苏时,应尽量缩短细胞暴露于高浓度DMSO的时间,以保护细胞活性。
传代和培养时定期观察细胞形态与增殖状态,确保小鼠外周血内皮祖细胞处于最佳生长条件下。
STR鉴定及相关
参考文献
上一篇:小鼠小肠血管内皮细胞(原代细胞)
下一篇:没有了

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值