 货号:STM-CL-5108 规格:1×10⁶cells/T25培养瓶或1mL冻存管
货号:STM-CL-5108 规格:1×10⁶cells/T25培养瓶或1mL冻存管
Hacat人永生化角质形成细胞 热销
- 来源:HaCaT细胞的来源是一位62岁的男性患者的病灶外围正常皮肤组织,是体外自发转化的永生化角质细胞。
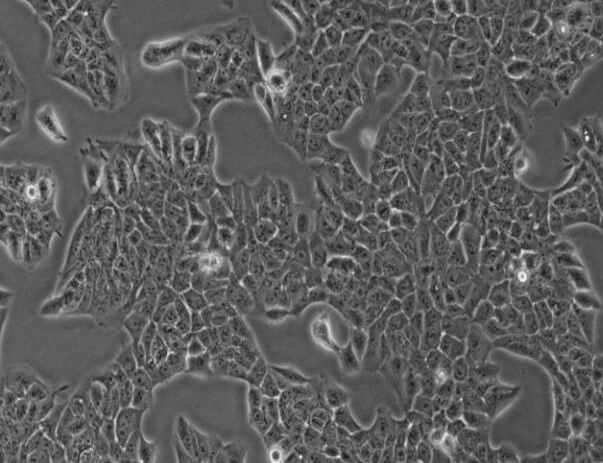
- 细胞特征:HaCaT细胞在培养条件下呈现贴壁生长的形态,具有典型的上皮细胞样式。
- 培养基:生长培养基:DMEM+10% FBS+1% P/S
- 其他:表达角蛋白、角化细胞交联外膜蛋白以及中间丝相关蛋白
HaCaT细胞的来源是一位62岁的男性患者(患有黑色素瘤)的病灶外围正常皮肤组织,是体外自发转化的永生化角质细胞。HaCaT细胞具有某些与皮肤癌相关的特性。hacat细胞系在体外培养中获得了永生化特性,能够无限期地增殖而不会自然凋亡。
细胞的特性:
HaCaT细胞的来源为一位黑色素瘤患者的正常皮肤组织,具有某些与黑色素瘤相关的特性。
虽然细胞源自患有黑色素瘤的患者,但HaCaT细胞本身并不是肿瘤细胞,而是永生化的表皮细胞系,保留了正常皮肤细胞的特性和功能。
HaCaT细胞因其在体外分化和增殖的高能力而被用于人表皮细胞角化的研究,并解决了培养寿命短和细胞系之间可能遇到的变异等问题。
它们表达角蛋白、角化细胞交联外膜蛋白以及中间丝相关蛋白,这些蛋白在角质形成和皮肤细胞分化中起着重要的作用。HaCaT细胞具有部分至完全分化的表型,这使得它们成为研究皮肤生物学和临床应用的理想模型。
形态和特性
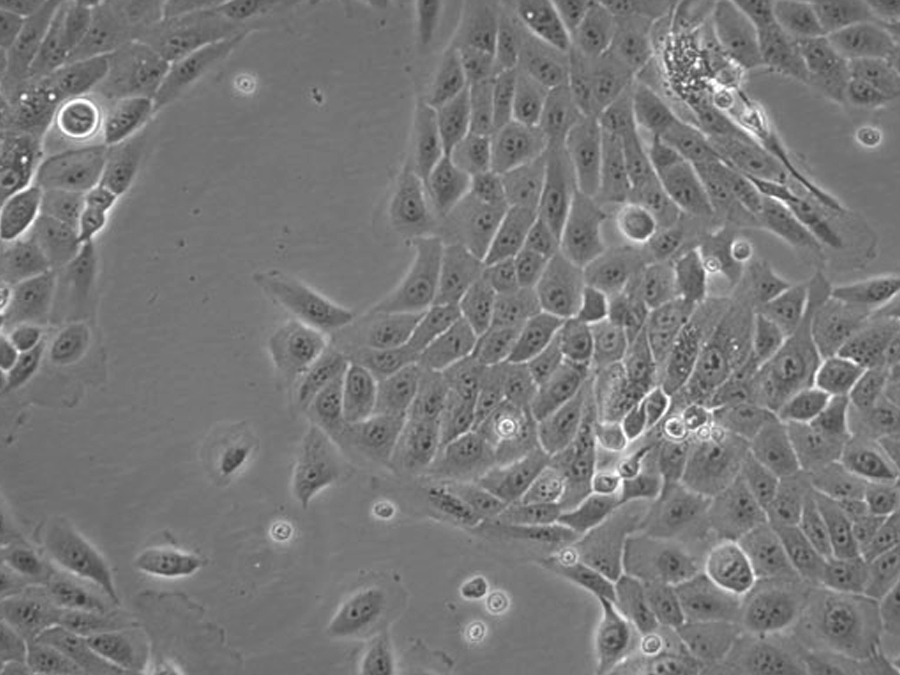
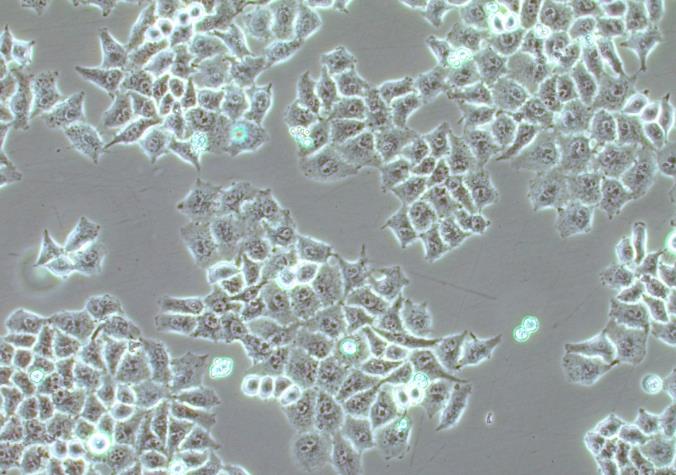
HaCaT细胞在培养条件下呈现贴壁生长的形态,聚团生长,具有典型的上皮细胞样式。该细胞传代后出现间隙颗粒物和悬浮细胞,贴壁细胞状态正常的情况下为正常现象,不影响增殖和实验。
Hacat人永生化角质形成细胞产品参数表
| 细胞名称 | HaCaT |
| 细胞别称 | HaCAT; HACAT; Hacat |
| 细胞来源 | 一位62岁患有黑色素瘤男性的病灶外围正常皮肤 |
| 细胞形态 | 上皮细胞样 |
| 细胞类型 | 正常细胞 |
| 生长特性 | 贴壁细胞 |
| 生物安全等级 | BSL1 |
| 培养基 | DMEM+10% FBS+1% PS |
| 培养条件 | 气相:空气,95%;CO2,5%;温度:37℃ |
| 冻存条件 | 基础培养基+5%DMSO+40%FBS,液氮保存 |
| 细胞倍增时间 | 2~3天 |
| 传代比例 | 1:2-1:4(具体情况视细胞生长速度及密度决定) |
| 保藏机构 | 协和细胞库PUMC |
| 应用 | 皮肤生物学、免疫学、药物毒性研究、皮肤疾病研究、化妆品和药物测试、银屑病 、湿疹等皮肤疾病的研究、药物和化妆品的测试。 |
| 特性 | HaCaT细胞具有永生化特性,角质形成特性,易于培养,广泛应用于皮肤生物学和临床研究。 |
| 角质形成特性 | HaCaT细胞在标准培养基和胎牛血清的高钙含量培养条件下,具有部分至完全分化的表型。 |
| 检测 | 支原体检测:阴性 |
培养教程
培养基本原理
HaCaT细胞在培养基中通过提供足够的营养物质和适宜的环境条件进行增殖和分化。培养基中的成分能够模拟体内细胞生长环境,促进细胞的正常生长和维持。
培养基准备
培养基成分:使用DMEM培养基,添加10%胎牛血清和抗生素。
混合均匀:将培养基组分混合均匀,过滤灭菌后存储于4℃避光条件下备用。
细胞复苏
解冻:将含有HaCaT细胞的冻存管放入37℃水浴中迅速解冻。
稀释:将解冻后的细胞悬液加入培养基中,并在1000RPM条件下离心5min。
移植:将上清液弃去,补加适量的完全培养基,然后将细胞悬液移植至培养瓶中过夜。
检查:第二天检查细胞密度,并进行换液。
细胞传代
条件:当细胞密度达到80%-90%时,即可进行传代培养。
消化:用胰蛋白酶-EDTA消化液对细胞进行消化,消化时间约为5-10分钟。
传代:按照1:3的比例将细胞转移到新的培养瓶中,完成传代培养过程。
培养注意事项
消化前清洗:消化前用PBS清洗细胞2-3次,保持培养环境的洁净。
均匀铺板:铺板时要均匀,避免局部生长过密难以消化的情况发生。
换液频率:每2~3天换液1次,保持培养环境的稳定。
消化时间控制:消化时间可能受细胞分化程度和融合度的影响,需根据实际情况进行控制。
冻存方法
添加剂:在培养基中添加40%FBS和5%DMSO作为冻存液。
冷冻保存:将细胞冷冻保存后,可在需要时解冻使用。
STR鉴定及相关
STR点位信息
| Amelogenin | X,Y |
| CSF1PO | 10,11 |
| D1S1656 | 11,12 |
| D2S441 | 11.3,14 |
| D2S1338 | 19,20 |
| D3S1358 | 15,16 |
| D5S818 | 11,12 |
| D7S820 | 10 |
| D8S1179 | 15,16 (DSMZ; Genomics_Center_BCF_Technion; PubMed=24116068; PubMed=25877200) |
| 15,16,17 (CLS) | |
| D10S1248 | 13 |
| D12S391 | 21,25 |
| D13S317 | 9,13 |
| D16S539 | 12,13 |
| D18S51 | 13,14 |
| D19S433 | 15.2 (CCRID; CLS; Genomics_Center_BCF_Technion; PubMed=24116068) |
| 16 (DSMZ) | |
| D21S11 | 29,31 |
| D22S1045 | 16 |
| DYS391 | 12 |
| FGA | 22,25 |
| Penta D | 9,13 |
| Penta E | 15,20 |
| TH01 | 9 |
| TPOX | 8,9 |
| vWA | 17 |
参考文献
- 消退素D1在HaCat细胞及咪喹莫特诱导的小鼠银屑病样皮肤炎症中的抗炎作用及机制研究 《华中科技大学》 2018年
- 摘要:第一部分SIRT1通过抑制NF-κB乙酰化减少脂多糖诱导的HaCaT细胞炎症因子分泌目的:...
- 慢病毒高效感染皮肤人永生化表皮细胞株HaCaT细胞的分化状态 中国组织工程研究 > 2014年29期
- 摘要:...的调节因子之一。<br> 目的:采用慢病毒-YY1感染HaCaT细胞观...
- 白芍总苷对HaCaT细胞外泌体的影响及机制研究 《实用临床医药杂志》 2022年07期
- 摘要:目的 探讨白芍总苷对HaCaT细胞增殖、侵袭、迁移能力及外泌体释放的影响与可能机制。方法 ...
- 银屑病皮损及缺氧条件下HaCaT细胞HIF-1α与血管生成相关蛋白表达关系的研究 《中南大学》 2010年
- 摘要:...皮损中HIF-1α与血管生成相关蛋白表达的关系;2.低氧培养HaCaT细胞中HIF-...
- 查看完整内容 >
上一篇:没有了

 细胞培养
细胞培养  细胞工程
细胞工程  细胞生物学
细胞生物学  参考文献
参考文献  关于思泰默
关于思泰默  品牌价值
品牌价值